Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Bílkovina
Z Multimediaexpo.cz

Bílkoviny, odborně proteiny, patří mezi biopolymery. Jedná se o vysokomolekulární přírodní látky s relativní molekulární hmotností 103 až 106 složené z aminokyselin.
Proteiny jsou podstatou všech živých organismů. Jejich základní povahu rozpoznal Henri Braconnot již v roce 1819 při zahřívání klihu s kyselinou sírovou. Za podrobnější znalost struktury bílkovin vděčíme E. Fischerovi a L. Paulingovi.
Obsah |
Základní vlastnosti bílkovin
V proteinech jsou aminokyseliny vzájemně vázány aminoskupinami –NH2 a karboxylovými skupinami –COOH amidovou vazbou –NH–CO– (amidy), která se v případě proteinů nazývá peptidová vazba.
Podle počtu aminokyselin, které jsou v molekule takto navázány, rozlišujeme
- oligopeptidy (2–10 aminokyselin)
- polypeptidy (11–100)
- vlastní bílkoviny - proteiny (více než 100 aminokyselin).
Pořadí aminokyselin v řetězci proteinu označujeme jako primární strukturu nebo také sekvenci. Z 20 aminokyselin (ve skutečnosti 22 - viz sekce proteinogenní aminokyseliny), které se vždy vyskytují v lidském organismu, může v případě jednoduchého proteinu, složeného ze 100 aminokyselin, vzniknout 22100 (tj. asi 1,747 . 10134 ) rozdílných primárních proteinových struktur. Z toho vyplývá, že existuje daleko větší množství různých proteinů, než je jich obsaženo ve všech živých organismech na Zemi. Struktura mnoha proteinů je již známá, např. myoglobinu a hemoglobinu; u blízce příbuzných živočišných druhů jsou si struktury velmi podobné.
Molekuly proteinů mohou vytvářet protáhlé, vláknité, ve vodě nerozpustné struktury, skleroproteiny (též fibrilární), a kulovité nebo elipsoidní, ve vodě rozpustné sferoproteiny (též globulární). V protikladu ke skleroproteinům (kolagen, keratin, fibroin, tvořící vlasy, rohovinu, chrupavky…) lze skoro u všech sferoproteinů (např. enzymy, svalová tkáň) varem nebo působením kyselin a louhů (změnou hodnoty pH) rozrušit jejich terciární a sekundární strukturu (koagulace, denaturace). Přitom se ztrácejí některé biologické vlastnosti proteinů, např. schopnost enzymů štěpit potravu nebo svalovou kontraktivitu. Tělu cizí proteiny vyvolávají svou přítomností reakci antigen–protilátka, a proto nesmí být nikdy přímo vpraveny do krevního oběhu.
Struktura bílkovin
Rozlišujeme primární, sekundární, terciární a u některých složitějších proteinů ještě kvartérní strukturu bílkovinného řetězce.
Primární struktura
Primární struktura je dána pořadím aminokyselin v polypeptidovém řetězci. Standardně se zapisuje od N-konce k C-konci proteinu. Poprvé ji stanovil v roce 1953 Frederick Sanger, čímž byla poprvé dokázána jedinečná kovalentní struktura bílkovin. Určuje chemické vlastnosti bílkoviny a také determinuje vyšší struktury.
Sekundární struktura
Sekundární struktura je prostorové uspořádání polypeptidového řetězce „na krátké vzdálenosti“, tzn. mezi několika po sobě jdoucími aminokyselinami. Poprvé byla určena v 30. a 40. letech 20. století. Jsou rozpoznávány různé druhy těchto stavebních motivů: alfa šroubovice (alfa-helix), struktura skládaného listu (beta-sheet), otočka (beta-hairpin), neuspořádaná struktura (random coil) a podobně.
Terciární struktura
Tímto pojmem se označuje trojrozměrné uspořádání celého peptidového řetězce. Obecně neexistuje jasná hranice mezi pojmy sekundární a terciární struktura, ale v bioinformatice se standardně hovoří o části řetězce (sekundární struktura) a celém řetězci (terciární struktura).
Kvartérní struktura
Řeší uspořádání podjednotek v proteinových aglomerátech, tvořících jednu funkční bílkovinu. Podjednotky jsou samostatné polypeptidické struktury, které jsou navzájem spojeny nekovalentními interakcemi. Kvartérní struktura též řeší prostorové uspořádání těchto podjednotek. Takovéto uspořádání vykazují jen složitější bílkoviny, např. fibrily kolagenu, nebo lidské DNA polymerázy.
Rozdělení na podjednotky přináší mnohé evoluční výhody oproti existenci jednoho ohromného řetězce. Při výskytu poruchy ve stavbě stačí nahradit poškozenou podjednotku, což je podobné stavbě budov za použití prefabrikátů. Místo výstavby podjednotky může být navíc odlišné od místa jejího výskytu. Bílkoviny se mohou skládat buď z odlišných (oligomery) nebo ze shodných podjednotek (protomery). Oblasti styku jednotlivých podjednotek jsou tvořeny především vodíkovými můstky a jinými nekovalentními interakcemi.
Symetrie
Bílkoviny většinou vykazují v oblasti spoje prvky symetrie. Nejjednodušší symetrií je cyklická symetrie. Označuje se Cn, kde n je počet protomerů uspořádaných v kruhu, který je středem symetrie. Jednotlivé protomery spolu svírají úhel 360°/n. Nejobvyklejší je C2 symetrie, kde jsou dvě podjednotky přímo proti sobě. Vyšší cyklické symetrie jsou poměrně vzácné.
Složitější symetrie se nazývá diedrální a značí se Dn. Takové dimery jsou v podstatě tvořeny dvěma cyklicky symetrickými polovinami, jedna z nich leží pod a druhá nad rovinou symetrie. Střed symetrie se pak nachází v polovině spojnice středů symetrie obou cyklicky symetrických polovin. Polypeptidy s takovýmto uspořádáním jsou poměrně snadno disociovatelné na dva cyklicky symetrické oligomery. K další disociaci na protomery v přírodních podmíkách obvykle nedochází, protože k jejímu dosažení by už bylo zapotřebí značně drastických podmínek.
Funkce bílkovin
Bílkoviny jsou základem všech známých organismů, a proto v něm plní různé funkce.
- Stavební (kolagen, elastin, keratin)
- Transportní a skladovací (hemoglobin, transferin)
- Zajišťující pohyb (aktin, myosin)
- Katalytické, řídící a regulační (enzymy, hormony, receptory…)
- Ochranné a obranné (imunoglobulin, fibrin, fibrinogen)
Proteinogenní aminokyseliny
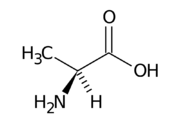
- Podrobnější informace naleznete na stránce: Aminokyselina#Aminokyseliny, které se vyskytují v proteinech
Kombinací 20 (ve skutečnosti 22) proteinogenních aminokyselin jsou tvořeny všechny známé bílkoviny. Jako tzv. 21. proteinogenní aminokyselina se označuje selenocystein (seCys). Tato aminokyselina nahrazuje cystein v lidském enzymu glutathionperoxidáze a v enzymech některých bakterií.[1] Jako 22. proteinogenní aminokyselina se označuje pyrolysin. Z 22 aminokyselin bývají některé řazeny mezi tzv. esenciální aminokyseliny, které tělo neumí syntetizovat a musí je přijímat s potravou.
Důkaz bílkovin
Pro důkaz bílkovin se používají následující reakce:
Metabolismus bílkovin
Metabolismus bílkovin je souhrn různých biochemických procesů, při nichž jsou syntetizovány a rozkládány bílkoviny.
Syntéza bílkovin
- Související informace naleznete v článku: Translace.
Základní stavební částicí bílkovin jsou aminokyseliny, a tak je zřejmé, že se bez nich tzv. proteosyntéza neobejde. Některé aminokyseliny je schopné tělo vyrábět samo, jiné musí přijímat v potravě (k těmto tzv. esenciálním aminokyselinám patří u člověka v dospělosti 12 aminokyselin, v dětství 14[2]). Bílkoviny jsou ve většině případů kódovány v specifických úsecích v DNA organismů. Tyto úseky (tzv. geny) jsou přepisovány v procesu transkripce do mRNA a na ribozomu následně dochází k výrobě proteinů (translaci) za účasti této mRNA a jednotlivých aminokyselin napojených na specifické tRNA.
Zvláštností jsou bílkoviny, které jsou kódovány v genomu a přepisovány do mRNA, nicméně nevznikají na ribozomu, nýbrž na speciálních rozpustných enzymech v cytoplazmě, jež jsou schopné mRNA číst podobně, jako ribozom. Říkáme jim neribozomální peptidy, protože obvykle nedosahují takové délky jako skutečné bílkoviny. Patří k nim některá polypeptidová antibiotika. Jejich produkce zůstane zachována i tehdy, zablokujeme-li ribozomální mašinérii. K těmto polypeptidům patří chloramfenikol a graminicin S. Mechanismus syntézy těchto antibiotik je trochu podobný syntéze mastných kyselin.[3]
Rozklad proteinů
Rozklad proteinů se také nazývá proteolýza. Bílkoviny se tráví na aminokyseliny, v krvi je určitá stálá hladina aminokyselin. Zdrojem aminokyselin jsou jednak bílkoviny z potravy, jednak opotřebované bílkoviny z tkání; malé množství aminokyselin vzniká při přeměně sacharidů. Aminokyseliny jsou potřebné: k syntéze stavebních bílkovin těla, k syntéze enzymů a hormonů, k syntéze plazmatických bílkovin, k přeměně na sacharidy. Část aminokyselin se odbourává na jednodušší látky a při tom se získává energie. Bílkoviny se neukládají do zásob. Při katabolickém odbourání aminokyselin dochází nejdříve k jejich deaminaci. Aminové skupiny se odštěpují ve formě toxického amoniaku, který je v jaterních buňkách v tzv. ornitinovém cyklu přeměněn na močovinu, jež je krví zanesena do ledvin a vyloučena močí z těla. Uhlíkaté zbytky aminokyselin se začleňují do Krebsova cyklu, kde jsou dekarboxylovány a dehydrogenovány.
Pozn.: 1 molekula močoviny = 3 ATP = ornitinový cyklus.
Enzymy štěpící bílkoviny jsou např. pepsinogen (žaludek), erepsin (tenké střevo), trypsin, chymotrypsin (slinivka břišní). Mezi hormony řídící štěpení bílkovin patří glukokortikoidy, somatotropin, testosteron a insulin.
Literatura
- Reisenauer R. et al.: CO JE CO? (1) Příručka pro každý den. Pressfoto - vydavatelství ČTK, Praha, 1982
- Encyklopedie Vševěd, http://www.vseved.cz
Reference
- ↑ KODÍČEK, M. selenocystein. From Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT Praha, 2007 [cit. 2008-10-21]. Available from [1]
- ↑ VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
- ↑ VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha : Victoria Publishing, 1995. ISBN 80-85605-44-9.
| Aminokyseliny |
|---|
|
Alanin • Arginin • Asparagin • Cystein • Fenylalanin • Glutamin • Glycin • Histidin • Isoleucin • Kyselina asparagová • Kyselina glutamová • |
| Speciální aminokyseliny |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |


