The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Kovalentní vazba
Z Multimediaexpo.cz
Kovalentní vazba je vnitromolekulární forma chemické vazby, kterou lze charakterizovat sdílením jednoho nebo více párů elektronů mezi dvěma prvky. Atomy účastnící se vazby si tímto způsobem zaplňují valenční vrstvu elektronového obalu. Energie kovalentní vazby je větší než energie intermolekulárních vodíkových vazeb.
Obsah |
Polarita vazby
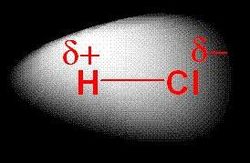
Na základě rozdílu elektronegativit prvků tvořících vazbu rozlišujeme polární a nepolární kovalentní vazbu. Polární vazba je tvořena prvky jejichž rozdíl elektronegativit je větší než 0,4 a menší 1,67. U nepolární vazby musí být hodnota tohoto rozdílu menší než 0,4. Vazby s rozdílem elektronegativit větším než 1,67 nazýváme iontové.
Rozdělení vazeb
- vazba sigma — místo maximálního překryvu orbitalů leží na spojnici jader vazebných atomů
- vazba pí — místo maximálního překryvu orbitalů leží mimo spojnici jader, orbitaly se překrývají ve dvou místech — např. p-p, p-d, d-d,
Pokud je mezi atomy dvojná nebo trojná vazba je vždy jedna vazba σ a ostatní jsou vazby π
Řád vazby
Řád vazby charakterizuje počet elektronových párů sdílených mezi atomy (nemusí být nutně celočíselný). Je roven rozdílu počtu vazebných a protivazebných elektronů, dělený dvěma.
- Jednoduchá vazba je tvořena sdílením jednoho elektronového páru (řád vazby je roven jedné). Jako příklad lze uvést vazbu mezi atomy vodíku a kyslíkem v molekule vody.
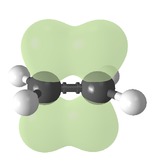
- Dvojná vazba je tvořena sdílením dvou elektronových párů (např. v molekule ethen; tvoří ji jedna sigma a jedna pi vazba).
- Trojná vazba je tvořena sdílením tří elektronových párů (např. v molekule ethynu; tvoří ji dvě pi a jedna sigma vazba).
- Čtverná vazba je tvořena sdílením čtyř elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní podílejí zedníci d-orbitaly. Je poměrně vzácná, popsána byla např. ve sloučeninách molybdenu a ruthenia.
- Byly již popsány i případy chemické vazby vykazující charakter paterné a šestené vazby.[1]
Reference
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |