The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Karboxylové kyseliny
Z Multimediaexpo.cz
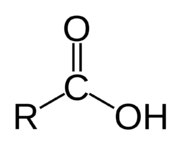
Karboxylové kyseliny jsou organické kyseliny, které obsahují karboxylovou skupinu -COOH. Karboxylové kyseliny, společně se svými solemi tvoří nezbytnou součást všech živých organismů. Jsou to substráty klíčových metabolických dějů a aminokyseliny, tedy kyseliny, které kromě karboxylové skupiny obsahují ještě skupinu aminovou (NH2), jsou základním stavebním kamenem bílkovin.
Obsah |
Charakteristika
V porovnání s minerálními kyselinami jsou kyselinami výrazně slabšími. Pro srovnání, disociační konstanta pKa nejsilnější karboxylové kyseliny, kyseliny mravenčí, je 3,75 zatímco pKa kyseliny sírové je -3,0. Míra kyselosti ještě klesá u vyšších homologů karboxylových kyselin. Je to dáno tím, že methylové skupiny působí kladným indukčním efektem, který stabilizuje protonovanou formu. Naopak destabilizuje iontovou formu kyseliny, protože zvětšuje její záporný náboj. Při disociaci se odštěpuje proton z karbonylové skupiny a vzniká karboxylátový anion:
- R-COOH + OH− → R-COO− + H2O
Hydroxylový aniont OH- vznikl disociací vody, druhým vzniklým iontem je oxoniový kationt H3O+. Po přídavku karboxylové kyseliny do vody se tedy disociací kyseliny a vznikem karboxylátového iontu odstraní část hydroxylových aniontů a vznikne přebytek oxoniových kationtů. Protože koncentrace (přesněji aktivita) oxoniových iontů určuje pH roztoku, čím větší aktivita H3O+, tím nižší pH, jsou vodné roztoky karboxylových kyselin kyselé. Disociační konstanta vyjadřuje ochotu sloučeniny disociovat; protože karboxylové kyseliny disociují málo, výsledné pH nebude ale nikdy příliš nízké. Disociační konstantu lze poněkud zvýšit přítomností silných elektronegativních skupin na atomu uhlíku přímo sousedícího s karboxylovou skupinou, jako jsou halogenidy. To totiž způsobí posun náboje v molekule a atom vodíku se snadněji odštěpuje. (např. kyselina trichloroctová je silnější než kyselina octová). Fyzikální vlastnosti karboxylových kyselin jsou závislé na délce řetězce:
| krátký řetězec | těkavá kapalina | zapáchající |
| delší řetězec | hustá, olejovitá kapalina | zapáchající |
| dlouhý řetězec | pevná krystalická látka | bez zápachu |
Karboxylová skupina je polární a vytváří proto vodíkové můstky. Ty mají přímý vliv na body varu i tání. Body varu rostou s délkou řetězce. Kyseliny se sudým počtem uhlíků mají vyšší bod varu než nejbližší vyšší a nižší karboxylové kyseliny s lichým počtem uhlíků. Podle podobnosti vyšších karboxylových kyselin s alkany, získaly tyto triviální název mastné kyseliny. Převažuje u nich lipofilní charakter a jsou tedy ve vodě nerozpustné. Dikarboxylové (např. kyselina šťavelová) nebo aromatické kyseliny (např. kyselina benzoová) jsou za laboratorních podmínek tuhé.
Názvosloví
Karboxylová skupina je v chemickém názvosloví organických sloučenin nejdůležitější skupinou. Proto se systematický název každé látky, která tuto skupinu obsahuje, skládá ze slova kyselina a přídavného jména s koncovkou -ová, resp. karboxylová. Jen když některá karboxylová skupina není započítána do základního řetězce, používá se předpona karboxy-. Jejich molekuly mohou obsahovat také jiné funkční skupiny (substituční deriváty), např. již zmíněnou aminovou skupinu (aminokyseliny), hydroxylovou skupinu -OH (hydroxykyseliny), nebo halogen. Kyseliny, které mají více než jednu karboxylovou skupinu se nazývají polykarboxylové kyseliny. Mnoho karboxylových kyselin má své triviální, častěji používané názvy. Například kyselina ethanová je častěji známa jako kyselina octová.
Vznik
Karboxylové kyseliny vznikají z uhlovodíků postupnou oxidací přes alkohol a aldehyd:
- R-CH3 → R-CH2-OH → R-CH=O → R-COOH
Reakce karboxylových kyselin
Neutralizace
Kromě výše popsané disociace mají karboxylové kyseliny ještě jednu schopnost vlastní kyselým látkám: reagují se zásadou v reakci, při které vzniká voda a sůl kyseliny. Jedná se o zvratnou reakci, sůl je totiž rozkládána vzniklou vodou. Soli vyšších karboxylových kyselin se nazývají mýdla.
- R-COOH + NaOH → R-COONa + H2O
Dekarboxylace
Při dekarboxylaci karboxylová kyselina ztrácí karboxylovou skupinu:
- HOOC-CH2-COOH → CH3-COOH + CO2
- stejně tak při kvašení kyseliny pyrohroznové (ethaniolové kvašení) dochází k z zániku k. skupiny a vzniku alkoholu (ethanolu) CH3COCOOH (+kvasinky, energie) → CH3CH2OH
Esterifikace
S alkoholy karboxylové kyseliny reagují za vzniku esterů. Reakce je zvláštní tím, že vodík OH skupiny alkoholů je kyselejší než karboxylová skupina, karboxylová kyselina se tedy v reakci chová jako zásada:
- R-COOH + R'-OH → R-COOR' + H2O
Mezi estery patří velké množství látek používaných jako chuťové esence v potravinách, například rumová esence je chemicky mravenčan ethylnatý. Naprostá většina lipidů jsou estery, nejčastější složka tuků a olejů je triacylglycerol, ester vyšších - mastných kyselin a trojsytného alkoholu glycerolu. Všeobecně známé jsou tyto tři vyšší mastné kyseliny - palmitová, stearová a olejová.
Dehydratace
kys. ftalová za dodání tepla reaguje a vzniká anhydrid této kyseliny a voda
Oxidace
oxiduje pouze kyselina mravenčí (HCOOH) za vzniku vody a CO2
Redukce
opačný "chod" vzniku karboxylových kyselin
Výskyt v přírodě
Karboxylové kyseliny jsou nepostradatelnou složkou živých organismů. Aminokyseliny jsou základem proteinů, tedy i enzymů, které umožňují složité metabolické procesy. Estery ve formě triacylglycerolů i dalších - tedy tuky a oleje - mají zásobní i strukturní funkci. Kyselina mravenčí je obsažena v kopřivách a jako svůj jed ji používají mravenci, včely a vosy. Kyselina octová vzniká při hnití rostlinných i živočišných produktů. Mnoho těchto kyselin je obsaženo také v ovoci a zelenině, např. kyselina šťavelová, jablečná nebo vinná. Jedna z metabolických drah, cyklus trikarboxylových kyselin, je ústředním centrem anabolických i katabolických procesů v těle. Aktivovaná kyselina octová, acetyl-CoA, je klíčovým, energii nesoucím substrátem.
Využití
Potravinářství
Mnoho karboxylových kyselin a jejich esterů má využití v potravinářství: zředěná kyselina octová - ocet - se používá jako okyselující i konzervační přísada. Hrušková a malinová esence jsou estery octové kyseliny. Kyselina mléčná dodává chuť kysanému zelí i kyselým okurkám, kyselina vinná, která se nachází ve zralém ovoci, se používá jako ochucovadlo ovocných nápojů, kterým dodává ovocnou chuť. Podobně se používá kyselina citrónová, která slouží i jako konzervační prostředek.
Výroba léčiv
Farmaceutický průmysl využívá kyseliny octové i mléčné, kyselina vinná slouží jako dávivý kámen. Kyselina salicylová a zvláště její ester, kyselina acetylsalicylová, jsou významným lékem proti zánětu a horečce (nesteroidní antiflogistika). Kyselina acetylsalicylová je účinnou látkou aspirinu.
Textilní průmysl
Umělé, acetátové hedvábí je esterem kyseliny octové. Z kyseliny tereftalové se vyrábí umělé vlákno terilen.
Přehled karboxylových kyselin
Nasycené monokarboxylové kyseliny
| Triviální název | Systematický název | Latinský název | Vzorec | Aniont* |
|---|---|---|---|---|
| kyselina mravenčí | methanová kyselina | acidum formicum | HCOOH | formiát |
| kyselina octová | ethanová kyselina | acidum aceticum | CH3COOH | acetát |
| kyselina propionová | propanová kyselina | acidum propionicum | CH3CH2COOH | propionát |
| kyselina máselná | butanová kyselina | acidum butyricum | CH3(CH2)2COOH | butyrát |
| kyselina valerová | pentanová kyselina | acidum valericum | CH3(CH2)3COOH | valerát |
| kyselina kapronová | hexanová kyselina | acidum capronicum | CH3(CH2)4COOH | kapronát |
| kyselina enanthová | heptanová kyselina | acidum enanthicum | CH3(CH2)5COOH | enanthát |
| kyselina kaprylová | oktanová kyselina | acidum caprylicum | CH3(CH2)6COOH | kaprylát |
| kyselina pelargonová | nonanová kyselina | acidum pelargonicum | CH3(CH2)7COOH | pelargonát |
| kyselina kaprinová | dekanová kyselina | acidum caprinicum | CH3(CH2)8COOH | kaprinát |
| kyselina undecylová | undekanová kyselina | acidum undecylicum | CH3(CH2)9COOH | undekylát |
| kyselina laurová | dodekanová kyselina | acidum lauricum | CH3(CH2)10COOH | laurát |
| kyselina tridecylová | kyselina tridekanová | - | CH3(CH2)11COOH | - |
| kyselina myristová | tetradekanová kyselina | acidum myristicum | CH3(CH2)12COOH | myristát |
| kyselina pentadecylová | kyselina pentadekanová | - | CH3(CH2)13COOH | - |
| kyselina palmitová | hexadekanová kyselina | acidum palmiticum | CH3(CH2)14COOH | palmitát |
| kyselina heptadecylová | kyselina heptadekanová | - | CH3(CH2)15COOH | - |
| kyselina stearová | oktadekanová kyselina | acidum stearicum | CH3(CH2)16COOH | stearát |
| - | kyselina nonadekanová | - | CH3(CH2)17COOH | - |
| kyselina arachidová | eikosanová kyselina | acidum arachidicum | CH3(CH2)18COOH | arachidát |
- * tyto názvy jsou odvozené od latinských názvů kyselin, názvy odvozené od českých názvů mají koncovku „-an“ (např.: octan)
Nasycené dikarboxylové kyseliny
| Triviální název | Systematický název | Latinský název | Vzorec | Aniont* |
|---|---|---|---|---|
| kyselina šťavelová | ethandiová kyselina | acidum oxalicum | (COOH)2 | oxalát |
| kyselina malonová | propandiová kyselina | acidum malonicum | COOH(CH2)COOH | malonát |
| kyselina jantarová | butandiová kyselina | acidum succinicum | COOH(CH2)2COOH | sukcinát |
| kyselina glutarová | pentandiová kyselina | acidum glutaricum | COOH(CH2)3COOH | glutarát |
| kyselina adipová | hexandiová kyselina | acidum adipicum | COOH(CH2)4COOH | adipát |
| kyselina pimelová | heptandiová kyselina | acidum pimelicum | COOH(CH2)5COOH | pimelát |
| kyselina suberová | oktandiová kyselina | acidum subericum | COOH(CH2)6COOH | suberát |
| kyselina azelaová | nonandiová kyselina | - | COOH(CH2)7COOH | - |
| kyselina sebaková | dekandiová kyselina | acidum sebacicum | COOH(CH2)8COOH | sebakát |
- * tyto názvy jsou odvozené od latinských názvů kyselin, názvy odvozené od českých názvů mají koncovku „-an“ (např.: šťavelan)
Mononenasycené monokarboxylové kyseliny
- kyselina akrylová (propenová kyselina, lat. acidum acrylicum) - CH2=CH-COOH
- kyselina metaakrylová (2-methylpropenová kyselina, lat. acidum metaacrylicum) - CH2=C(CH3)COOH
- kyselina krotonová (trans-2-butenová) - CH3CH2=CH-COOH
- kyselina palmitoolejová (cis-9-hexadecenová) - CH3(CH2)7CH=CH(CH2)5COOH
- kyselina olejová (cis-9-oktadecenová kyselina, lat. acidum oleicum) - CH3(CH2)7CH=CH(CH2)7COOH
- kyselina elaidová (trans-9-oktadecenová kyselina)- CH3(CH2)7CH=CH(CH2)7COOH
- kyselina eruková (cis-13-dokosenová kyselina) - CH3(CH2)7CH=CH(CH2)11COOH
Polynenasycené monokarboxylové kyseliny
- kyselina linolová (cis,cis-9,12-oktadekadienová, lat. acidum linoleicum) - CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
- kyselina gama-linolenová (cis,cis,cis-6,9,12-oktadekatrienová, lat.acidum linolenicum) - CH3(CH2)4CH=CH-CH2CH=CHCH2CH=CH(CH2) 4COOH
- kyselina alfa-linolenová (cis,cis,cis-9,12,15-oktadekatrienová, lat.acidum linolenicum) - CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH
- kyselina arachidonová (cis,cis,cis,cis-ikosa-5,8,11,14-tetraenová, lat. acidum arachidonicum)
Nenasycené polykarboxylové kyseliny
- kyselina maleinová (cis-butendiová, lat. acidum maleinicum) - COOH-CH=CH-COOH
- kyselina fumarová (trans-butendiová, lat. acidum fumaricum) - COOH-CH=CH-COOH
- kyselina akonitová (propentrikarboxylová kyselina)
Pozn. kyselina maleinová a fumarová, podobně jako kyselina olejová a elaidová se liší polohou skupin COOH vůči dvojné vazbě. Jedná se o tzv. cis-trans izomerii.
Deriváty karboxylových kyselin
- Podrobnější informace naleznete v článku Deriváty karboxylových kyselin.
Deriváty karboxylových kyselin obsahují další funkční skupinu nebo mají pozměněnou karboxylovou skupinu a proto mají další charakteristické vlastnosti.
Funkční deriváty
Náhrada probíhá na karboxylové skupině.
- Soli karboxylových kyselin - kyselý vodík karboxylové skupiny je nahrazen kationtem kovu nebo amonným kationtem. Obecný vzorec: R-CO-OMe
- Halogenidy karboxylových kyselin neboli acylhalogenidy - skupina OH je nahrazena atomem halogenu. Obecný vzorec: R-CO-X
- Anhydridy karboxylových kyselin - dvě karboxylové skupiny jsou propojeny za odštěpení molekuly vody. Obecný vzorec: R-CO-O-CO-R'
- Estery karboxylových kyselin - kyselý vodík karboxylové skupiny je nahrazen alkylem. Obecný vzorec: R-CO-O-R'
- Amidy - skupina OH je nahrazena amidovou skupinou NH2. Obecný vzorec: R-CO-NH2
- Imidy - dvě karboxylové skupiny jsou propojeny přes imidovou skupinu NH. Obecný vzorec: R-CO-NH-CO-R'
Substituční deriváty
Náhrada na řetězci mimo karboxylovou skupinu. (Většinou se podobně jako v alkanech nahrazuje atom vodíku.)
- Halogenkarboxylové kyseliny - atom H je nahrazen halogenem
- Hydroxykyseliny - řetězec obsahuje hydroxylovou skupinu -OH
- Oxokyseliny - řetězec obsahuje karbonylovou skupinu - aldehydovou (-CHO) nebo ketoskupinu (-CO-)
- Aminokyseliny - řetězec obsahuje aminoskupinu -NH2
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |