Přejeme Vám krásné svátky a 52 týdnů pohody a štěstí v roce 2025 !
Dusík
Z Multimediaexpo.cz
| |||||||||||||||||||||||||
| Obecné | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název, Značka, Číslo | Dusík, N, 7 | ||||||||||||||||||||||||
| Skupina prvků | Nekovy | ||||||||||||||||||||||||
| Skupina, Perioda, Blok | 5 (V.A), 2 , p | ||||||||||||||||||||||||
| Vzhled | bezbarvý plyn | ||||||||||||||||||||||||
| Atomové vlastnosti | |||||||||||||||||||||||||
| Atomová hmotnost | 14,0067 amu | ||||||||||||||||||||||||
| Atomový poloměr (vypočten) | 65 (56) pm | ||||||||||||||||||||||||
| Kovalentní poloměr | 75 pm | ||||||||||||||||||||||||
| van der Waalsův poloměr | 155 pm | ||||||||||||||||||||||||
| Elektronová konfigurace | [He]2s22p3 | ||||||||||||||||||||||||
| e- na energetickou hladinu | 2, 5 | ||||||||||||||||||||||||
| Oxidační čísla | ±3, ±2, ±1, 4, 5, (silně kyselý) | ||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||
| Hustota | 1,2506 kg/m³ (při 273 K) | ||||||||||||||||||||||||
| Skupenství | plyn | ||||||||||||||||||||||||
| Teplota tání | 63,14 K (-210,01 °C) | ||||||||||||||||||||||||
| Teplota varu | 77,35 K (-195,80 °C) | ||||||||||||||||||||||||
| Krystalová struktura | šesterečná | ||||||||||||||||||||||||
| Tvrdost | — | ||||||||||||||||||||||||
| Magnetické chování | — | ||||||||||||||||||||||||
| Molární objem | 13,54 10-6 m3/mol | ||||||||||||||||||||||||
| Skupenské teplo varu | 2,7928 kJ/mol | ||||||||||||||||||||||||
| Skupenské teplo tání | 0,3604 kJ/mol | ||||||||||||||||||||||||
| Tlak nasycené páry | ND Pa při __ K | ||||||||||||||||||||||||
| Rychlost zvuku | 334 m/s při 298,15 K | ||||||||||||||||||||||||
| Různé | |||||||||||||||||||||||||
| Elektronegativita | 3,04 (Paulingova stupnice) | ||||||||||||||||||||||||
| Měrná tepelná kapacita | 1040 J/(kg.K) | ||||||||||||||||||||||||
| Elektrická vodivost | ND 106/m ohm | ||||||||||||||||||||||||
| Tepelná vodivost | 0,02598 W/(m.K) | ||||||||||||||||||||||||
| 1. ionizační potenciál | 1402,3 kJ/mol | ||||||||||||||||||||||||
| 2. ionizační potenciál | 2856 kJ/mol | ||||||||||||||||||||||||
| 3. ionizační potenciál | 4578,1 kJ/mol | ||||||||||||||||||||||||
| 4. ionizační potenciál | 7475,0 kJ/mol | ||||||||||||||||||||||||
| 5. ionizační potenciál | 9444,9 kJ/mol | ||||||||||||||||||||||||
| 6. ionizační potenciál | 53266,6 kJ/mol | ||||||||||||||||||||||||
| 7. ionizační potenciál | 64360 kJ/mol | ||||||||||||||||||||||||
| Nejstabilnější izotopy | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Pokud není uvedeno jinak, jsou použity jednotky SI a STP. | |||||||||||||||||||||||||
Dusík, chemická značka N (lat. Nitrogenium) je plynný chemický prvek, tvořící hlavní složku zemské atmosféry. Patří mezi biogenní prvky, které jsou základními stavebními kameny živé hmoty.
Obsah |
Historický vývoj
V druhé polovině 18. století byla objevena složka vzduchu, která nepodporuje hoření ani dýchání. Tento plyn popsal jako první Němec Carl Wilhelm Scheele v roce 1777 a pojmenoval ho Francouz Antoine Lavoisier jako azote, což znamená dusivý plyn. Po té co bylo zjištěno, že je kyselina dusičná odvozena od dusíku, pro něj Chaptal navrhl název nitrogéne, což znamená ledkotvorný, který se udržel v latinském označení nitrogenium.
Vlastnosti
Dusík je plyn bez barvy, chuti a zápachu. Není toxický ani jinak nebezpečný. Dusík je v atmosféře tvořen dvouatomovými molekulami, které jsou spojené velmi pevnou trojnou vazbou. Tato trojná vazba má za následek jeho nízkou reaktivitu. Dusík je inertní plyn, to znamená, že reaguje s jinými chemickými sloučeninami pouze za vysokých teplot a tlaků. Za laboratorní teploty reaguje pouze s lithiem a plutoniem. Za vysokých teplot se však dusík slučuje s většinou prvků - např. s kyslíkem okolo teploty 2 500 °C.
Naproti tomu atomární dusík je velmi reaktivní a nelze ho uchovávat. Jeho vysoká reaktivita spočívá v tom, že má ve valenční vrstvě 3 nepárové elektrony. Stability docílí tím, že buď přijme tři elektrony a vytvoří stabilní oktet ve valenční sféře N3- nebo odevzdá až 5 elektronů a získá tím kladnou valenci např. N1+, N3+ nebo N5+.
Dusík má po kyslíku a fluoru třetí největší hodnotu elektronegativity a proto u něj převládá schopnost vytvářet anion, který se nazývá nitridový N3-. Pouze ve sloučeninách s kyslíkem a fluorem je schopen tvořit ionty, kde se uplatňuje v kladné valenci. Například v dusičnanech má dusík oxidační číslo N5+.
Výskyt v přírodě
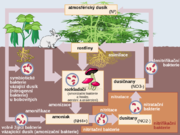
- Související informace můžete najít také v článku: Koloběh dusíku
V elementární podobě se s dusíkem setkáváme prakticky neustále, tvoří totiž 78 % (objemových) zemské atmosféry. Ve stopách se v atmosféře vyskytuje také amoniak, který se uvolňuje tlením organických sloučenin, při elektrickém výboji (například blesku). Při blesku může také dojít v atmosféře k reakci dusíku s kyslíkem za vzniku oxidu dusnatého, který ihned reaguje s kyslíkem za vzniku oxidu dusičitého a ten reaguje s vzdušnou vlhkostí a kyslíkem za vzniku kyseliny dusičné, která se vyskytuje v kyselých deštích.
Vzhledem k rozpustnosti prakticky všech svých anorganických solí se téměř nevyskytuje v běžných horninách. Všechny tyto látky byly v průběhu času dávno spláchnuty do oceánů a tam se opět zapojily do různých biologických cyklů. Výjimkou je např. chilský ledek neboli dusičnan sodný NaNO3, který pravděpodobně vznikl rozkladem rostlinných a živočišných látek zejména na chilském pobřeží. Významným zdrojem organického dusíku jsou především objemné vrstvy ptačího trusu, nazývané guano a využívané především jako hnojivo.
Dusík je významný biogenní prvek, který se vyskytuje ve významných organických sloučeninách a ve všech živých organismech. Rostliny ho přijímají kvůli svému růstu a nevylučují ho. Živočichové ho využívají k tvorbě bílkovin a vylučují ho v podobě močoviny nebo amoniaku.
Příprava
Laboratorní příprava
- Nejvýhodnější laboratorní příprava čistého dusíku se provádí zahříváním koncentrovaného roztoku dusitanu amonného nebo směsi roztoku chloridu a dusitanu amonného. Aby se odstranily stopy přimíšených oxidů dusíku, promývá se dusík směsí dvojchromanu draselného a kyseliny sírové.
- NH4NO2 → N2+2 H2O
- Často se ještě dusík v laboratoři připravuje vedením vzduchu přes rozžhavenou měď. Měď reaguje s kyslíkem a vzniká černý oxid měďnatý. Vzniklý dusík není úplně čistý, protože vzduch obsahuje okolo 1% argonu a dalších vzácných a netečných plynů. Tomuto dusíku se říká atmosferický dusík.
- Další možná příprava dusíku v laboratoři, při které získáme obzvláště čistý dusík, je tepelný rozklad amoniaku. Při tomto postupu vedeme amoniak přes práškový nikl při teplotě 1000 °C. Vodík poté od dusíku oddělíme na základě odlišných teplot varu.
Průmyslová výroba
- Dusík se technicky dříve připravoval vedením vzduchu přes rozžhavené uhlí nebo koks. Oxid uhličitý se od dusíku odstraní promýváním ve vodě jako vedlejší produkt. Takto vzniklý dusík obsahuje okolo 1% vzácných a dalších netečných plynů a nazývá se atmosferický dusík.
- Dusík se dnes prakticky výlučně vyrábí frakční destilací zkapalněného vzduchu a tvoří přitom spíše přebytky při výrobě více žádaného kyslíku. Při frakční destilaci se vzduch provádí několika komorami a nakonec je velmi ochlazen. Na základě rozdílných teplot varu se tak oddělí jednotlivé složky vzduchu. První se oddělí kyslík, poté dusík, dále vodík a nakonec vzácné plyny.
Použití
Amoniak a následně z něj vyrobená kyselina dusičná jsou látky, které se vyrábí v chemickém průmyslu velmi mnoho. Amoniak hlavně jako hnojivo a chemická látka k výrobě dalších amonných a jiných sloučenin a kyselina dusičná jako významné oxidovadlo, které se používá i k dalším anorganickým a organickým syntézám.
Plynný dusík
Plynný dusík nalézá využití jako inertní atmosféra např. v prostředí, kde hrozí nebezpečí výbuchu, při výrobě integrovaných obvodů, nerezové oceli a používá se k plnění obalů výrobků, aby nedošlo k jejich zmačkání a zvlhčení - například sáčky s brambůrky.
Kapalný dusík
Kapalný dusík se využívá v řadě kryogenních procesů, při nichž je třeba udržet prostředí na značně nízké teplotě. Příkladem je např. uchovávání tkání nebo spermií a vajíček v lázni z kapalného dusíku. Kapalným dusíkem jsou chlazeny polovodičové detektory rentgenového záření v různých spektrometrických aplikacích.
Hnojiva
Dusíkatá hnojiva jsou látky, které se rostlinám dodávají, aby rostly rychleji. Rostliny dusík nevylučují a plně ho využívají k růstu. Rostliny, které byly hnojeny dusíkatými hnojivy poznáme podle velkého vzrůstu, velkých listů, ale takovéto rostliny se lehce ve větru lámou a jsou málo celkově odolné.
- Amoniak NH3 a jeho sloučeniny jsou jedním z nejvyužívanějších hnojiv v zemědělství. Plynný amoniak se v poslední době stává náhradou freonů v chladírenství. Amoniak se vyrábí přímou syntézou z plynů tzv. Haberovým procesem.
- Dusičnan amonný NH4NO3 je další často používané hnojivo bohaté na obsah dusíku. Dnes se však stejně jako síran amonný (NH4)2SO4 a dusíkaté vápno neboli kyanamid vápenatý CaCN2 využívá méně. Dusičnan amonný se také využívá k výrobě výbušnin, bengálských ohňů a samozápalných směsí.
- Močovina (NH2)2CO neboli diamid kyseliny uhličité se jako hnojivo v poslední době využívá stále více. Její výroba je nenáročná a velmi levná. Močovina se také používá k výrobě kopolymerů jako jsou například močovinoformaldehydové pryskyřice.
Ostatní dusičnany, které se používají jako hnojiva, nejsou sami o sobě významné. Používají se hlavně ve směsi s dalšími látkami a vytváří tak komplexní hnojiva. Například dusičnan sodný NaNO3 a dusičnan draselný KNO3.
Výbušniny
Mimořádných oxidačních vlastností sloučenin dusíku s valencí N+5 se již od dávnověku využívá při výrobě explozivních látek. Již v starověké Číně byla známa výroba střelného prachu, jehož podstatnou složku tvoří dusičnan sodný nebo draselný. V současné době se v tomto oboru uplatňují spíše organické sloučeniny, ať již jde o nitroglycerin nebo trinitrotoluen zkratka TNT.
Další použití
- Jako paliva raketových motorů se v minulosti používala jak kyselina dusičná jako oxidační činidlo, tak hydrazin jako zdroj spalovaného vodíku.
- Organické sloučeniny dusíku jako například aminy se používají k výrobě barviv a léčiv. Jiné dusíkaté organické deriváty se používají například k výrobě indikátorů v analytické chemii,
Sloučeniny
Anorganické sloučeniny
Mezi anorganické sloučeniny dusíku se řadí amoniak a jeho deriváty, oxidy dusíku a dusíkaté kyseliny, peroxokyseliny a jejich soli.
Amoniak a jeho deriváty
Mezi deriváty amoniaku se řadí amidy, imidy a nitridy, které vznikají nahrazováním atomů vodíků v jeho molekule. Dále hydrazin, hydroxylamin, halogenidy a oxidohalogenidy dusíku a sloučeniny síry s dusíkem.
- Amoniak NH3 je plyn lehčí než vzduch, bez barvy, rozpustný ve vodě, má charakteristický štiplavý zápach, leptá sliznice a používá se jako hnojivo a surovina pro výrobu dalších anorganických a organických sloučenin. Při rozpouštění amoniaku ve vodě se reakcí s vodou tvoří z části molekul amoniaku tzv. hydroxid amonný.
- Derivát, který vzniká nahrazením jednoho atomu vodíku v amoniaku, se nazývá amid nebo amin. Amidy jsou deriváty amoniaku, které obsahují náhradou vodíku za kov (např. amid sodný NaNH2) nebo si je můžeme představit odvozené náhradou skupiny OH v kyselinách za skupinu -NH2 (např. diamid kyseliny uhličité neboli močovina (NH2)2CO). Jako aminy se označují ostatní sloučeniny (např. chloramin NH2Cl). Toto dělení se používá pouze pro anorganické sloučeniny, v organických sloučeninách tyto názvy označují jiné sloučeniny.
- Derivát, který vzniká nahrazením dvou atomů vodíku v amoniaku, se nazývá imid nebo imin. Anion má tvar >NH2-. Rozdíl mezi imidem a iminem a použití těchto názvů je stejné jako u amidu a aminu.
- Derivát, který vznikne odtržením všech atomů vodíku z amoniaku, se nazývá nitrid nebo (pouze v některých sloučeninách) nitril. Jako nitril se označuje velmi málo sloučenin (např. kyselina nitrilosulfonová N(SO3H)3). Nitridy jsou obecně dvouprvkové sloučeniny dusíku s jinými prvky. Většinou to jsou pevné látky s velmi vysokými teplotami tání a varu.
- Hydrazin N2H4 je bezbarvá, na vzduchu silně dýmající kapalina. Má zásaditý charakter a je schopen tvořit soli hydrazínia. Hydrazin se používá je redukční činidlo a raketové palivo.
- Hydroxylamin NH2OH nelze snadno připravit ve volném stavu, protože látka snadno detonuje. Stabilnější jsou její soli hydroxylaminia. Roztok hydroxylaminu reaguje silně zásaditě.
- Mezi halogenidy dusíku řadíme fluorodusík NF3, chlorodusík NCl3 a jododusík NI3. Bromodusík se nepodařilo připravit čistý, ale pouze je amoniakát NBr3.6 NH3. Fluorodusík je bezbarvý plyn, chlorodusík těkavá tmavě žlutá olejovitá kapalina a jododusík hnědočervená pevná látka. Všechny tyto látky jsou velmi nebezpečné, protože jsou velmi lehce explozivní, jododusík již při dotyku.
- Oxidohalogenidy dusíku obsahují kromě dusíku a halogenu ještě kyslík. Známé jsou zatím sloučeniny, které mají stechiometrické složení NOF, NO2F, NO3F, NOCl, NO2Cl a NOBr. Všechny tyto látky jsou za pokojové teploty plyny a až na NOCl a NOCl, které jsou červené, nemají barvu.
- Mezi sloučeniny síry s dusíkem patří několik látek. Nejznámější mají složení S4N4 tetranitrid síry a S4N2 dinitrid síry. Obě dvě jsou pevné krystalické látky, které při zahřátí detonují a rozkládají se na dusík a síru.
Oxidy dusíku
Oxidy dusíku jsou známy s dusíkem valence N+1 až N+5. Oxidy dusíku s mocenstvím N+2 až N+5 jsou hlavními složkami tzv. suchého neboli losangelského smogu.
- Oxid dusný N2O, nazývaný také rajský plyn je bezbarvý plyn, slabého zápachu a nasládlé chuti, který byl v dřívějších dobách používán jako narkotikum při chirurgických operacích a dnes se používá jako hnací plyn ve sprejích.
- Oxid dusnatý NO je bezbarvý plyn, velmi jedovatý, který při kontaktu s kyslíkem reaguje na oxid dusičitý. Ve vodě je velmi málo rozpustný a řadí se mezi inertní oxidy. Je to důležitý meziprodukt při výrobě kyseliny dusičné.
- Oxid dusitý N2O3 je temně modrá kapalina, která se za pokojové teploty rychle rozkládá na oxid dusnatý a oxid dusičitý. Stabilní je vedle těchto oxidů pouze v rovnováze.
- Oxid dusičitý NO2 je hnědočervený, silně jedovatý plyn charakteristického zápachu, který za pokojové teploty dimeruje na N2O4, který je bezbarvý. Oxid dusičitý je posledním meziproduktem při výrobě kyseliny dusičné a snadno se rozpouští ve vodě za vzniku kyseliny dusité a kyseliny dusičné.
- Oxid dusičný N2O5 je bezbarvá krystalická, která se na vzduchu rychle rozplývá. Oxid dusičný není stabilní a může bez vnější příčiny explodovat. Při reakci s ozonem lze získat sloučeninu s větším množstvím kyslíku, která má složení NO3 a nazývá se peroxid nitrosylu. Snadno se rozkládá a nelze ji získat v čistém stavu.
Kyseliny dusíku
Nejstálejší a nejdůležitější kyselinou dusíku je kyselina dusičná, další známé kyseliny dusíku jsou kyselina dusitá a kyselina azidovodíková a další dvě téměř neznámé kyseliny dusíku jsou kyselina dusná a kyselina dusnatá.
- Kyselina azidovodíková HN3 je bezbarvá, ostře páchnoucí kapalina s jedovatými parami, které explodují velmi prudce pokud přijdou do styku s horkým předmětem. Ve vodném roztoku je kyselina azidovodíková stálá. Je to slabá kyselina (ještě slabší než kyselina octová). Její soli azidy jsou ve vodě velmi dobře rozpustné a jsou stálejší než volná kyselina.
- Kyselina dusná H2N2O2 je bílá krystalická látka, která je v suchém stavu krajně explozivní. Dobře se rozpouští ve vodě a lihu. Je to velmi slabá kyselina, protože její disociace v roztoku je nepatrná. Její soli jsou znatelně stabilnější a nazývají se dusnany neboli hyponitrily.
- Kyselina dusnatá H4N2O4 je zatím známá pouze v podobě svých solí, protože se jí doposud nepodařilo připravit.
- Kyselina dusitá HNO2 je látka stálá pouze v chladných, silně zředěných roztocích. Při vyšší teplotě nebo ve větší koncentraci se rozkládá na kyselinu dusičnou, oxid dusnatý a vodu. Soli kyseliny dusité, dusitany neboli nitrity, jsou na rozdíl od kyseliny znatelně stabilnější a mají praktické využití při organických syntézách např. diazotaci.
- Kyselina dusičná HNO3 je v čistém stavu bezbarvá kapalina, která se ve větší koncentraci na světle rozkládá na oxid dusičitý, vodu a kyslík. Kyselina je silné oxidační činidlo. Je to jedna z průmyslově nejvyráběnějších látek a má velmi široké množství použití v průmyslu stejně jako její soli, dusičnany neboli nitráty.
Organické sloučeniny
Mezi organické sloučeniny dusíku se řadí nitrosloučeniny, nitrososloučeniny, aminy, amoniové soli, kyanatany neboli kyanáty, isokyanatany neboli isokyanáty, thiokyanatany neboli thiokyanáty, isothiokyanatany neboli isothiokyanáty, azosloučeniny, diazoniové soli, deriváty hydrazinu, deriváty hydroxylaminu, aminokyseliny, amidy kyselin, hydrazidy kyselin, laktamy, imidy kyselin a nitrily kyselin. Zvláštní skupinou organických sloučenin dusíku jsou heterocyklické sloučeniny a nitráty.
Nitrosloučeniny a Nitrososloučeniny
- Nitrosloučeniny obsahují v molekule skupinu -NO2. Jsou to mimořádně silná oxidační činidla a některé z nich jsou významnými produkty chemického průmyslu explozivních látek. Typickým příkladem je nitroglycerin, trinitrotoluen nebo pentryt.
- Nitrosoloučeniny obsahují skupinu -NO a jsou to deriváty uhlovodíků, které vznikají náhradou atomu vodíku na terciárním atomu uhlíku. Např. nitrosobenzen.
Aminy a amoniové soli
- Aminy jsou deriváty amoniaku, které vznikají náhradou atomů vodíku v jeho molekule, a dělí se na primární se skupinou -NH2, sekundární se skupinou =NH a terciární se skupinou =N-. Aminoskupina je přítomna ve všech aminokyselinách, které jsou základní stavební jednotkou bílkovin. Nejdůležitějším aromatickým aminem je anilín.
- Atom dusíku v aminech má stejně jako v amoniaku volný elektronový pár. Aminy jsou tedy zásadami, mohou poutat H+ a tvořit amoniové soli.
Kyanatany a jejich deriváty
- Kyanatany vznikají nahrazením atomu vodíku v uhlovodíku skupinou -O-CΞN
- Isokyanatany vznikají nahrazením atomu vodíku v uhlovodíku skupinou -N=C=O
- Thiokyanatany vznikají nahrazením atomu vodíku v uhlovodíku skupinou -S-CΞN
- Isothiokyanatany vznikají nahrazením atomu vodíku v uhlovodíku skupinou -N=C=S
Azosloučeniny a diazoniové soli
- Azosloučeniny jsou dusíkaté deriváty obsahující skupinu -N=N-, na tuto skupinu se mohou vázat dva stejné nebo různé uhlovodíkové zbytky. Např. 4-[4-(dimethylamino)fenylazo]benzen-1-sulfonová kyselina neboli triviálně methyloranž jehož sodná sůl se používá jako indikátor.
- Diazoniové soli jsou dusíkaté deriváty obsahující funkční skupinu -N+ΞN.
Deriváty hydroxylaminu a hydrazinu
- Deriváty hydroxylaminu NH2OH jsou dusíkaté deriváty obsahující skupinu -NHOH nebo >NOH
- Deriváty hydrazinu NH2NH2 jsou dusíkaté derivát, které mají vodíkové atomy v hydrazinu substituované uhlovodíkovými zbytky, ktreé mohou, ale nemusí být stejné.
Aminokyseliny
- Aminokyseliny jsou dusíkaté a kyslíkaté deriváty, které obsahují aminoskupinu -NH2 a karboxylovou skupinu -COOH. Aminokyseliny jsou základní stavební jednotky bílkovin a v organiskech se vyskytuje pouze 20 proteinogenních aminokyselin (tzn. takových, které se vyskytují v bílkovinách). Všechny tyto aminokyseliny mají triviální názvy, až na glycin jsou opticky aktivní a patří mezi tzv. L-aminokysleiny.
- R-aminokyseliny se vyskytují pouze v savčích mozcích a mají zde důležitou funkci při mozkových pochodech, jako je uchovávání informací v paměťi.
Amidy, imidy, nitrily a hydrazidy kyselin
- Amidy jsou dusíkaté deriváty, které obsahují amidovou skupinu -CO-NH2. Amid vzniká reakcí karboxylové kyseliny s amoniakem R1COOH+NH3 → R1CO-NH2+H2O
- Imidy jsou dusíkaté deriváty, které obsahují imidovou skupinu -CO-NH-CO-. Ta vzniká reakcí dvou karboxylových kyselin s amoniakem R1COOH+NH3+R2COOH → R1CO-NH-COR2+2 H2O.
- Nitrily jsou dusíkaté deriváty, které obsahují nitrilovou skupinu -CΞN. Pokud pojmenováváme tyto sloučeniny jako nitrily, tak se uhlík vázaný na dusík zahrnuje do názvu uhlovodíkového zbytku. Pokud bychom chtěli pojmenovávat tyto sloučeniny jako kyanidy, tak se uhlík vázaný na dusík nezahrnuje do názvu uhlovodíkového zbytku.
- Hydrazidy jsou dusíkaté deriváty, které obsahují hydrazidovou skupinu R-CO-NH-NH2. V hydrazinu mohou být nahrazeny až všechny čtyři atomy vodíku. R1COOH+NH2NH2 → R1-NH-NH2+H2O.
Laktamy
- Laktamy neboli vnitřní amidy vznikají zacyklením, nejčastěji 4-8 uhlíkatého, aminů karboxylových kyseliny. Na jednom konci uhlíkatého řetězce je aminoskupina a na druhém kaboxylová skupina. Laktam vznikne reakcí karboxylové skupiny a aminoskupiny v jedné molekule.
Nitráty
- Nitráty jsou dusíkaté deriváty, které obsahují nitroskupinu -O-NO2. Nitráty uhlovodíků vznikají tzv. nitrací, která se provádí v prostředí kysleiny sírové a dusičné (nitrační směs). Nitráty hydroxysloučenin se provádí reakcí alkoholů nebo fenolů s kyselinou dusičnou.
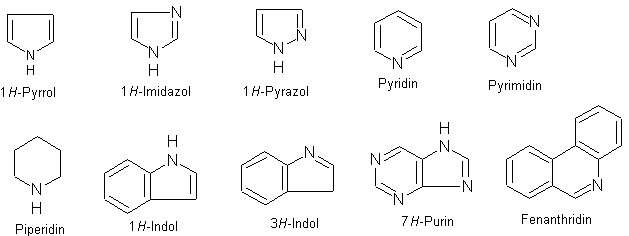
Heterocyklické sloučeniny
- Mezi nejdůležitější heterocyklické sloučeniny obsahující v molekule atom dusíku patří
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jaroslav Fikr, Jaroslav Kahovec; Názvosloví organické chemie; 2. vydání
- P. Karlson; Základy biochemie; vydání 1965
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
- Materiály z přednášek z letního odborného chemického soustředění v Běstvině 2006
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |