The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Fosfor
Z Multimediaexpo.cz
| Fosfor | |
| Atomové číslo | 15 |
| Relativní atomová hmotnost | 30,973 amu |
| Elektronová konfigurace | [Ne] 3s2 3p3 |
| Skupenství | Pevné |
| Teplota tání | 44,2 °C (317,3 K) |
| Teplota varu | 277 °C (550 K) |
| Elektronegativita (Pauling) | 2,19 |
| Hustota | 1,823 g/cm3 (bílý) |
| Hustota | 2,34 g/cm3 (červený) |
| Hustota | 2,69 g/cm3 (černý) |
Obsah |
Základní fyzikálně - chemické vlastnosti
Fosfor je nekovový prvek, vyskytující se v přírodě pouze ve formě sloučenin. V nich se běžně setkáváme s fosforem v mocenství P+5, ale existují sloučeniny, v nichž se fosfor vyskytuje v mocenství P-3, P+3 i P+4.
Elementární fosfor se vyskytuje ve 3 alotropních modifikacích – bílý, červený a černý fosfor.
Bílý fosfor
Bílý fosfor je tvořen z molekul P4, které jsou příčinou jeho vysoké reaktivity. Je to měkká látka nažloutlé barvy (někdy se proto označuje jako žlutý fosfor), kterou lze krájet nožem; je značně jedovatý a na vzduchu samovznětlivý. Ve tmě jeho páry fosforeskují, protože dochází k oxidaci par vzdušným kyslíkem, při které vydává světlo. Mnohými látkami se fosforescence zeslabuje. Pro dlouhodobější uchovávání musí být ponořen ve vodě, která brání jeho samovolnému vzplanutí. Je nerozpustný ve vodě, ale dobře se rozpouští v sirouhlíku CS2. Bílý fosfor je velmi reaktivní látka, která se již za pokojové teploty slučuje s mnoha prvky a látkami. V teplém roztoku hydroxidu draselného KOH se rozpouští za vzniku dihydrogenfosforečnanu draselného KH2PO4 a fosforovodíku neboli fosfanu PH3. Kovy, které se snadno redukují (především ušlechtilé kovy), vylučuje fosfor z jejich sloučenin a zčásti s nimi tvoří fosfidy.
Červený fosfor
Červený fosfor vzniká zahřátím bílého fosforu v inertním prostředí na 250 °C v uzavřené nádobě. Tato přeměna probíhá i za normálních podmínek působením světla, ale velmi pomalu. Červený fosfor nesvětélkuje, je na vzduchu neomezeně stálý, není rozpustný v polárních ani nepolárních rozpouštědlech (není rozpustný ve vodě ani v sirouhlíku), má teplotu tání 597 °C, není jedovatý a s většinou prvků se slučuje až při vyšších teplotách. Reaktivnější než červený fosfor je tzv. světle červený fosfor, který je jemně rozptýlenou formou červeného fosforu. Tento fosfor vzniká varem bílého fosforu s bromidem fosforitým, rozpouští se v roztocích hydroxidů a vytěsňuje některé kovy z roztoků jejich sloučenin. Červený fosfor má polymerní strukturu vyskytuje se ve čtyřech modifikacích (např. fialový fosfor). Fialový fosfor má hustotu o něco vyšší než čistý červený fosfor a připravuje krystalizací z roztaveného olova. Při zahřívání se mění v bílý fosfor.
Černý fosfor
Černý fosfor je velmi stálý a svými fyzikálními vlastnostmi připomíná spíše kovy. Má kovový lesk, je tepelně i elektricky dobře vodivý a má vrstvenou polymerní strukturu. Svými chemickými vlastnosti se velmi podobá červenému fosforu, ale na vlhkém vzduchu se oxiduje rychleji. Vzniká zahříváním červeného fosforu pod tlakem za teploty přes 400 °C nebo zahříváním bílého fosforu za teploty 200 °C a tlaku 12 000 atmosfér nebo pohodlněji zahříváním bílého fosforu za teploty 380 °C a přítomnosti jemně rozptýlené kovové rtuti. Ze všech tří modifikací je černý fosfor do teploty 550 °C termodynamicky nejstabilnější modifikací.
Historický vývoj
Historicky byl fosfor poprvé izolován německým alchymistou Heningem Brandtem v roce 1669, který se snažil, jako všichni alchymisté, najít kámen mudrců. Nechal několik dní rozkládat lidskou moč, pak ji zahustil a nakonec destiloval při vysokých teplotách. Páry nechal zkondenzovat pod vodou a získal tak voskovitou látku, která ve tmě světélkovala. Brand nazval tuto látku z řeckého phosphorus : phos - světlo a phoros - nesoucí, tedy světlonoš, konkrétně se jednalo o fosfor bílý.Robert Boyle tento způsob v roce 1680 zdokonalil a v následujících letech připravil oxid fosforečný a kyselinu fosforečnou. Za chemický prvek ho prohlásil teprve Antoine Lavoisier.
Výskyt v přírodě
V přírodě se setkáme pouze se sloučeninami fosforu (ojedinělý a pochybný nález minerálu fosforu je uváděn z meteoritu nalezeném v Townshipské salině v Kansasu v USA). V zemské kůře se fosfor vyskytuje poměrně hojně, je celkově 11. prvkem v pořadí výskytu a jeho koncentrace se průměrně odhaduje na 1 – 1,2 g/kg. V mořské vodě je jeho koncentrace velmi nízká, pouze 0,07 mg P/l, ve vesmíru připadá na jeden atom fosforu pouze přibližně 3 000 000 atomů vodíku.
Nejdůležitějším minerálem s obsahem fosforu je směsný fosforečnan vápenatý – apatit, jehož složení lze vyjádřit jako: Ca5(PO4)3X (X = OH, F, Cl). Apatit slouží jako základní surovina pro výrobu fosforu a především jeho sloučenin. Hlavní oblasti těžby leží v Rusku (poloostrov Kola), Maroku a v USA.
Dalšími minerály s obsahem fosforu jsou např. fosforit Ca3(PO4)2, fluoroapatit Ca5(PO4)3F a méně významné wavelit 3 Al2O3.2 P2O5.12 H2O a vivianit Fe3(PO4)2.8 H2O.
Dále se fosfor vyskytuje ve všech živých organizmech na Zemi, je především uložen v kostech a zubech, ale je složkou důležitých organických molekul jako DNA a RNA, energetických přenašečů (ADP, ATP) a je obsažen ve většině tuků, neboli lipidů.
Rostlinami je přijímán, stejně jako ostatní minerální látky, z vody, a to ve formě aniontu H2PO4. V rostlině se neredukuje. Vzhledem ke svému zápornému náboji (uvnitř buňky je záporný náboj) a vysoké intrabuněčné koncentraci je jeho příjem energeticky velmi náročný, přijímá se neustále a vysokoafinními transportéry. Při příjmu pomáhá mykorhiza. V rostlině se vyskytuje volný (jako fosfátový aniont H2PO4) i vázaný. Volný může být skladován ve vakuole.
Výroba
Základem průmyslové výroby elementárního fosforu je redukce fosforečnanů koksem (uhlíkem) za přítomnosti křemenného písku podle rovnice:
- Ca3(PO4)2 + 3 SiO2 → 3 CaSiO3 + P2O5
- P2O5 + 5 C → 5 CO + 2 P
Souhrnně
- 2 Ca3(PO4)2 + 6 SiO2 + 10 C → P4 + 6 CaSiO3 + 10 CO
Fosfor za vysoké teploty (okolo 1300 °C) v tavenině těká jako molekula P4 a je zachycován po kondenzaci ve vodě jako bílý fosfor. Při zahřívání bílého fosforu v inertní atmosféře, přechází do modifikace červeného fosforu, která má vrstevnatou strukturu Pn.
Dnes již téměř nepoužívaná metoda výroby je Pelletierova metoda. Při ní se fosforečnan vápenatý převádí v prostředí mírně koncentrované kyseliny sírové na dihydrogenfosforečnan vápenatý. V druhém kroku je odstraněna sádra a dihydrogenfosforečnan vápenatý je redukován koksem při teplotě 1000 °C v šamotových pecích.
- Ca3(PO4)2 + 2 H2SO4 + 4 H2O → 2 CaSO4.2 H2O + Ca(H2PO4)2
- 3 Ca(H2PO4)2 + 10 C → Ca3(PO4)2 + 10 CO + 4 P + 6 H2O
Použití
Vlastnosti a použití fosforu je silně závislé na alotropní formě, ve které se fosfor právě vyskytuje.
Bílý fosfor
- Toxických vlastností bílého fosforu se dodnes využívá při výrobě jedovatých nástrah na krysy a jiné hlodavce.
- Bílý fosfor se také využívá k výrobě farmaceutických preparátů.
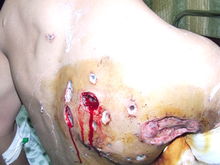
- Schopnost samovznícení bílého fosforu při styku se vzduchem se v polovině minulého století využívalo k výrobě samozápalných leteckých pum a dělostřeleckých granátů. Zákeřnost těchto zbraní spočívala v tom, že hořící fosfor způsobuje mimořádně těžké popáleniny a špatně hojitelné popáleniny. Je velmi obtížné jej uhasit (jediný spolehlivý způsob je ponoření do vody).
- Do počátku 20. století se používal k výrobě zápalek, později byl zakázán a nahradil jej červený fosfor.
Bílý fosfor jako zbraň
Bílý fosfor se dá také použít jako nekonvenční zbraň (někdy je dokonce klasifikován jako chemická zbraň hromadného ničení). Pravděpodobně poprvé byl použit bratrstvem feniánů v 19. století[1], známy jsou případy jeho použití v první a druhé světové válce, Korejské válce a válce ve Vietnamu, válce v Čečně. V roce 1988 Saddám Hussein užil bílého fosforu při plynovém útoku v Halabja. V nedávné minulosti použili Američané bílý fosfor jak v Afghánistánu,[2] tak v Iráku proti sunnitským povstalcům bitvě o Falúdžu.[3] [4] Bílý fosfor byl též použit Izraelem v operaci Lité olovo.[5][6][7][8]
Použití bílého fosforu ve válce je obvykle vnímáno jako kontroverzní záležitost a to zejména v hustě obydlených oblastech s civilním obyvatelstvem. Existuje více dokumentů upravujících použití bílého fosforu v boji, ale ne všechny jsou závazné pro všechny státy. Situaci komplikuje i více způsobů užití. Ačkoliv je bílý fosfor jedovatý, nebývá zpravidla použit jako chemická zbraň, ale jako hořlavina. Může sloužit k osvícení bojiště, označení cílů nebo naopak k zahalení bojiště kouřem. Používá se také k ničení (v podstatě upalování) živé síly nepřítele nebo k vyhnání nepřátelských bojovníků z bezpečných úkrytů a případně též k podlomení jejich bojové morálky. Různé možnosti použití vedou často k tomu, že obě bojující strany a jejich sympatizanti jednotlivé případy nasazení bílého fosforu interpretují zcela rozdílným způsobem.
Účinky bílého fosforu na lidský organismus
Bílý fosfor může být použit jako součást „fosforové“ bomby, kdy efektem na lidský organismus jsou velmi vážné, velmi často smrtelné, popáleniny; devastující účinky má i ve formě aerosolu nebo hustého dýmu, který je produktem jeho hoření.
Červený fosfor
- Přesto, že není samovznětlivý, je červený fosfor schopen vzplanout při silnějším lokálním zahřátí, vyvolaném např. mechanickým třením. Díky této vlastnosti je červený fosfor dodnes základní surovinou pro výrobu běžných kuchyňských zápalek. Zároveň se tyto vlastnosti uplatní při výrobě různých pyrotechnických potřeb – zápalky, roznětky a další.
- Červený fosfor je výchozí sloučeninou pro přípravu téměř všech sloučenin obsahujících fosfor.
Černý fosfor
- Díky svým kovovým vlastnostem se nejvíce využívá v elektrotechnice při výrobě polovodičů typu N (negativních), které mají elektronovou vodivost.
Slitiny
Elementární fosfor se v menším množství přidává do slitin kovů pro úpravu jejich fyzikálních vlastností. Jeho přítomnost ve slitinách značně zvyšuje tvrdost výsledného produktu. Významné je legování fosforu do stříbrných pájek a bronzů, ale i některých speciálních ocelí.
Další využití
- Fosforečnany jsou důležitá rostlinná hnojiva. Z fosforečnanu vápenátého se vyrábí hydrogenfosforečnan vápenatý, který je málo rozpustný ve vodě a do půdy se vsakuje postupně, a dihydrogenfosforečnan vápenatý známý jako superfosfát, který je ve vodě dobře rozpustný a do půdy se rozpadá na ionty okamžitě. V zemědělství se ale nepoužívají čistě fosforečnanová hnojiva, ale tzv. kombinovaná hnojiva, která jsou směsí hnojiv dusíkatých, draselných, sodných a mnoha dalších, které rostliny potřebují k růstu.
- Vápenaté a sodné fosforečnany se přidávají do zubních past. Slouží jako součást odrezovacích roztoků pro odstraňování korozních produktů z povrchu železných konstrukcí, protože velmi snadno reagují s oxidem železitým.
- Sodné soli kyseliny fosforečné se uplatňují jako součást prášků na praní nebo prostředků na mytí nádobí v automatických myčkách pro změkčení vody (Na3 PO4), dále v potravinářství při výrobě sýrů a nakládání šunky Na2HPO4. Jejich přítomnost ve vodě má také antikorozivní účinky a přidávají se do cirkulačních vod pro vytápění (ústřední topení, průmyslové vyhřívací okruhy).
- Fosforečnany amonné (NH4)2HPO4 a NH4H2PO4 slouží v zemědělství jako velmi účinná hnojiva. Přidávají se také jako samozhášecí přísada do celulózy s cílem zmenšit hořlavost výsledných výrobků (divadelní kulisy).
Sloučeniny
Fosfor se vyskytuje ve velké řadě různých anorganických i organických sloučenin. Z řady anorganických sloučenin mají z hlediska praktického využití největší význam:
- Kyselina trihydrogenfosforečná H3PO4 je středně silná, trojsytná minerální kyselina. Vyrábí se spalováním elementárního fosforu v přítomnosti vodní páry. Koncentrovaná kyselina fosforečná je těžká, viskosní kapalina s velmi vysokým bodem varu. V pevném stavu je to bezbarvá krystalická látka, silně hygroskopická. Tvoří celkem 3 řady solí - fosforečnany (PO4)3-, hydrogenfosforečnany (HPO4)2- a dihydrogenfosorečnany (H2PO4)-.
- Další kyseliny fosforu jsou kyseliny fosforitá H3PO3, kyselina fosforičitá H4P2O6, kyselina fosforná H3PO2 a kyselina fosforečná HPO3. Některé kyseliny fosforu dokáží polymerovat.
- Oxid fosforečný se vyskytuje ve formě dimerních molekul jako P4O10 a je to bílá, silně hygroskopická krystalická látka. Připravuje se spalováním bílého fosforu za dostatečného přístupu vzduchu. Reakcí s vodou vznikají různé formy fosforečných kyselin. V praxi se používá pro sušení plynů, protože velmi ochotně a rychle absorbuje i stopy vodních par.
- Oxid fosforitý tvoří dimer P4O6, který je bílá, velmi jedovatá krystalická látka. Ve studené vodě se pozvolna rozpouští za vzniku kyseliny fosforité a v horké vodě se rozkládá za vzniku fosfanu a kyseliny trihydrogenfosforečné. Oxid fosforitý se vyrábí spalováním bílého fosforu za nedostatečného přístupu vzduchu.
- Oxid fosforičitý tvoří také dimer P2O4, který tvoří bezbarvé , silně lesklé krystaly. Ve vodě se rozpouští za značného vývoje tepla a rozpouští se za vzniku kyseliny fosforité a kyseliny trihydrogenfosforečné. Připravuje se termickým rozkladem oxidu fosforitého.
- Chloridy fosforu jsou celkem tři. PCl2 chlorid fosfornatý je nesnadno získatelná látka, která vzniká působením elektrického výboje na směs PCl3 a H2. Je to bezbarvá olejovotá kapalina, silně páchnoucí po fosforu. PCl3 chlorid fosforitý vzniká spalováním fosforu v přítomnosti chloru, je to bezbarvá kapalina. PCl5 chlorid fosforečný vzniká spalováním fosforu v nadbytku chloru, je to bílá krystalická látka, která při 100 °C sublimuje aniž taje. PCl3 a PCl5 ve vodě hydrolyzují za vzniku svých trojsytných kyselin.
- Nitrid fosforečný P3N5 je bezbarvý prášek, bez chuti a zápachu. Připravuje se působením amoniaku na sulfid fosforečný.
- Sloučeniny s vodíkem jsou jedovaté a značně reaktivní. Fosfan PH3 je jedovatý plyn se zápachem po česneku, difosfan P2H4 je samozápalná kapalina. Fosfan lze nejlépe připravit působením vody na jodid fosfonia [PH4]I
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Reference
- ↑ část převzata z článku White phosphorus (weapon) na anglické Wikipedii
- ↑ Afghan girl's burns show horror of chemical strike, agentura Reuters, 8. května 2009, (český překlad)
- ↑ http://aktualne.centrum.cz/zahranici/amerika/clanek.phtml?id=2220
- ↑ http://www.novinky.cz/clanek/141166-ve-faludzi-se-rodi-postizene-deti-iracane-vini-usa.html
- ↑ Organizace Human Rights Watch: Izraelská armáda používá v Gaze bílý fosfor
- ↑ Izraelci používají v Gaze bílý fosfor
- ↑ V Gaze používáme fosfor, přiznal Izrael. Ale dle práva
- ↑ Izrael čelí obvinění, že v Gaze používá zakázané fosforové bomby
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |