Multimediaexpo.cz je již 18 let na českém internetu !!
Fosfid
Z Multimediaexpo.cz
m (1 revizi) |
m (+ Vylepšení) |
||
| Řádka 1: | Řádka 1: | ||
| - | [[Soubor:Boron-phosphide-unit-cell-1963-CM-3D-balls.png|thumb|Struktura například [[fosfid boritý|fosfidu boritého]] a dalších fosfidů]] | + | [[Soubor:Boron-phosphide-unit-cell-1963-CM-3D-balls.png|thumb|230px|Struktura například [[fosfid boritý|fosfidu boritého]] a dalších fosfidů]] |
| - | [[Soubor:Sodium-phosphide-xtal-Na-coordination-3D-balls.png|thumb|Struktura [[fosfid sodný|fosfidu sodného]]]] | + | [[Soubor:Sodium-phosphide-xtal-Na-coordination-3D-balls.png|thumb|230px|Struktura [[fosfid sodný|fosfidu sodného]]]] |
'''Fosfid''' je sloučenina [[fosfor]]u s nějakým méně [[elektronegativita|elektronegativním]] prvkem nebo prvky. Dvouprvkové sloučeniny tvoří fosfor s většinou prvků s výjimkou [[rtuť|rtuti]], [[olovo|olova]], [[antimon]]u, [[bizmut]]u, [[tellur]]u a [[polonium|polonia]].<ref name="Schnering">{{citace monografie| jméno=H.G. |příjmení=Von Schnering, |jméno2=W.|příjmení2= Hönle |kapitola=Phosphides - Solid state chemistry| titul=Encyclopedia of Inorganic Chemistry |editor= R. Bruce King |rok=1994|vydavatel= John wiley & Sons |isbn= 0471936200}}</ref> Poměr prvků ve fosfidech může být poměrně variabilní, například [[draslík]] tvoří devět fosfidů: K<sub>3</sub>P, K<sub>4</sub>P<sub>3</sub>, K<sub>5</sub>P<sub>4</sub>, KP, K<sub>4</sub>P<sub>6</sub> K<sub>3</sub>P<sub>7</sub>, K<sub>3</sub>P<sub>11</sub>, KP<sub>10.3</sub>, KP<sub>15</sub>), [[nikl]] jich má osm (Ni<sub>3</sub>P, Ni<sub>5</sub>P<sub>2</sub>, Ni<sub>12</sub>P<sub>5</sub>, NiP<sub>2</sub>, Ni<sub>5</sub>P<sub>4</sub>, NiP, NiP<sub>2</sub>, NiP<sub>3</sub>).<ref name = "Schnering"/> Většina jich je dobře rozpustná v tucích. | '''Fosfid''' je sloučenina [[fosfor]]u s nějakým méně [[elektronegativita|elektronegativním]] prvkem nebo prvky. Dvouprvkové sloučeniny tvoří fosfor s většinou prvků s výjimkou [[rtuť|rtuti]], [[olovo|olova]], [[antimon]]u, [[bizmut]]u, [[tellur]]u a [[polonium|polonia]].<ref name="Schnering">{{citace monografie| jméno=H.G. |příjmení=Von Schnering, |jméno2=W.|příjmení2= Hönle |kapitola=Phosphides - Solid state chemistry| titul=Encyclopedia of Inorganic Chemistry |editor= R. Bruce King |rok=1994|vydavatel= John wiley & Sons |isbn= 0471936200}}</ref> Poměr prvků ve fosfidech může být poměrně variabilní, například [[draslík]] tvoří devět fosfidů: K<sub>3</sub>P, K<sub>4</sub>P<sub>3</sub>, K<sub>5</sub>P<sub>4</sub>, KP, K<sub>4</sub>P<sub>6</sub> K<sub>3</sub>P<sub>7</sub>, K<sub>3</sub>P<sub>11</sub>, KP<sub>10.3</sub>, KP<sub>15</sub>), [[nikl]] jich má osm (Ni<sub>3</sub>P, Ni<sub>5</sub>P<sub>2</sub>, Ni<sub>12</sub>P<sub>5</sub>, NiP<sub>2</sub>, Ni<sub>5</sub>P<sub>4</sub>, NiP, NiP<sub>2</sub>, NiP<sub>3</sub>).<ref name = "Schnering"/> Většina jich je dobře rozpustná v tucích. | ||
== Třídění == | == Třídění == | ||
Aktuální verze z 20. 6. 2019, 14:02

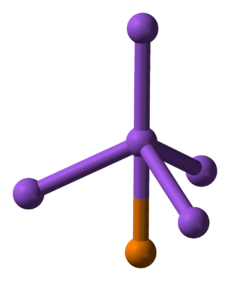
Fosfid je sloučenina fosforu s nějakým méně elektronegativním prvkem nebo prvky. Dvouprvkové sloučeniny tvoří fosfor s většinou prvků s výjimkou rtuti, olova, antimonu, bizmutu, telluru a polonia.[1] Poměr prvků ve fosfidech může být poměrně variabilní, například draslík tvoří devět fosfidů: K3P, K4P3, K5P4, KP, K4P6 K3P7, K3P11, KP10.3, KP15), nikl jich má osm (Ni3P, Ni5P2, Ni12P5, NiP2, Ni5P4, NiP, NiP2, NiP3).[1] Většina jich je dobře rozpustná v tucích.
Třídění
Třídění fosfidů je komplikované.[2] Na základě struktury a reaktivity mohou být fosfidy klasifikovány do těchto skupin:[1]:
- fosfidy iontové, obsahující anionty P3−. Tvoří je alkalické kovy (M3P, např. Na3P) a kovy alkalických zemin (M3P2, např. Ca3P2)
- polyfosfidy obsahující např. iont P24−, iont P113−; polymerní řetězcovité ionty (např. šroubovicovitý P−)n a některé trojrozměrné složité struktury)
- fosfidy s jedním atomem fosforu, polovodiče (např. GaP) až vodiče (TaP)[3]
Polyfosfidové ionty P34− (vyskytující se v K4P3) a P45− (vyskytující se v K5P4) jsou radikálové anionty s lichým počtem valenčních elektronů, což z nich činí paramagnetické látky.[1]
Výskyt v přírodě
Schreibersit – vzorec (Fe,Ni)3P, je běžně přítomen v některých druzích meteoritů.[4][5]
Reference
- ↑ 1,0 1,1 1,2 1,3 VON SCHNERING,, H.G.; HÖNLE, W.. Encyclopedia of Inorganic Chemistry. [s.l.] : John wiley & Sons, 1994. ISBN 0471936200. Kapitola Phosphides - Solid state chemistry.
- ↑ GREENWOOD, Norman N.; EARNSHAW, A.. Chemistry of the Elements. 2. vyd. Oxford : Butterworth-Heinemann, 1997. ISBN 0-7506-3365-4.
- ↑ C. S. Blackman, C. J. Carmalt, S. A. O'Neill, I. P. Parkin, K. C. Molloy, L. Apostolico. Chemical vapour deposition of group Vb metal phosphide thin films. J. Mater. Chem., 2003, čís. 13.
- ↑ Mindat
- ↑ Handbook of Mineralogy
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
