The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Dovolená : 23. prosinec 2025 — 29. prosinec 2025
Holidays : December 23, 2025 — December 29, 2025
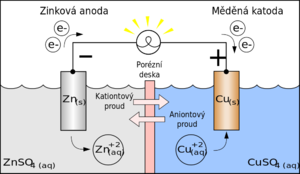
Galvanický článek
Z Multimediaexpo.cz
Galvanický článek je chemický zdroj elektrického napětí.
Elektromotorické napětí galvanického článku
Elektromotorické napětí na galvanickém článku vzniká z rozdílu potenciálů na elektrodách, elektrické potenciály jsou důsledkem chemických reakcí mezi elektrodami a elektrolytem. Tyto reakce mohou být samovolné nebo vyvolané průchodem elektrického proudu (elektrolýzou). Matematicky: \(U = U_1 - U_2\) za podmínky \(U_1 > U_2\) , kde U1 je napětí 1. elektrody a U2 je napětí 2. elektrody
Galvanický článek v elektrickém obvodu
Po zapojení článku do elektrického obvodu probíhají uvnitř článku reakce, kterými se postupně snižuje elektrická energie uložená v článku, článek se vybíjí. Tyto reakce mohou být nevratné - napětí článku se po vybití nedá obnovit (primární články) - nebo vratné - článek se dá znova nabít (sekundární články, též akumulátory). Při průchodu elektrického proudu článkem se projeví vnitřní odpor článku. Vnitřní odpor Ri má za následek snížení napětí článku na svorkové napětí U:
- \(U = U_e - R_i I\) , kde Ue je elektromotorické napětí, I je elektrický proud (při vyšším zatížení - vyšším proudu - se napětí článku sníží více).
Galvanický článek je vždy zdroj stejnosměrného proudu. V elektrických obvodech, kde záleží na směru proudu, je třeba před zapojením zkontrolovat správnou polaritu elektrod.
Složení galvanických článků
Při sestavování galvanického článku se pro elektrody a elektrolyty používají takové kombinace chemických látek, aby potenciál vznikající na elektrodě byl pokud možno co největší a zároveň aby článek co nejdéle vydržel. Vhodnými a nejčastěji používanými látkami pro zápornou elektrodu jsou zinek, kadmium, lithium a hydridy různých kovů, pro kladnou elektrodu uhlík (grafit) obklopený burelem MnO2, nikl a stříbro. Jako elektrolyt se používá v suchých článcích a olověném akumulátoru roztok kyselin nebo jejich solí, v alkalických článcích a akumulátorech roztok zásaditých sloučenin alkalických kovů. Případné další látky v galvanických článcích mají za úkol regulovat chemické reakce tak, aby se např. prodloužila životnost článku, snížila možnost úniku nebezpečných látek, ap.
Parametry galvanických článků
- druh článku - primární (po vybití se nedá nabít) nebo sekundární (akumulátor, dá se nabít)
- elektromotorické napětí - velikost napětí mezi elektrodami nezatíženého článku
- vnitřní odpor - velikost odporu článku při průchodu elektrického proudu, články s malým vnitřním odporem se označují jako tvrdé zdroje, články s velkým vnitřním odporem se označují jako měkké zdroje
- elektrický výkon - množství energie, které je článek schopen dodat za jednotku času
- celková elektrická energie, kterou lze dostat z čerstvého článku až do úplného vybití
- měrná energie - podíl celkové energie a hmotnosti článku
- hustota energie - podíl celkové energie a objemu článku
- životnost článku - doba dodávání energie při běžném zatížení
- nabíjecí proud a nabíjecí doba - pro sekundární články (akumulátory)
- účinnost - podíl vydané a dodané energie u akumulátorů
- cena - ovlivněna cenou materiálu (burel a zinek levnější, stříbro a lithium dražší)

Přehled galvanických článků
Ue = elektromotorické napětí
em = měrná energie (E/m, kde E je elektrická energie, m je hmotnost)
eV = hustota energie (E/V, kde E je elektrická energie, V je objem)
hodnoty em a ev platí pro čerstvý článek, při vybíjení se snižuje
+ kladná elektroda
− záporná elektroda
elektrolyt - vždy roztok uvedené látky
| název článku | elektrody | elektrolyt | Ue [V] | em [kJ/kg] | eV [MJ/m3] | poznámka |
|---|---|---|---|---|---|---|
| primární články | ||||||
| Voltův článek | +měď Cu −zinek Zn | kyselina sírová H2SO4 | 1 | ? | ? | historicky první zdroj stálého elektrického proudu (1800) |
| zinko-uhlíkový článek (Leclancheův článek) | +uhlík C −zinek Zn | salmiak NH4Cl + burel MnO2 | 1,5 | 240 | 450 | obyčejné baterie |
| alkalický článek | +burel MnO2 −zinek Zn | hydroxid draselný KOH | 1,5 | 280 | 900 | kvalitnější baterie |
| zinko-stříbrný článek | +stříbro Ag −zinek Zn | hydroxid draselný KOH | 1,5 | 440 | 1400 | velmi kvalitní baterie |
| Bunsenův článek | +Uhlík C −zinek Zn | Kyselina sírová, Kyselina dusičná | 1,9 | ? | ? | vyšší proudy |
| lithiový článek | +burel MnO2 −lithium Li | lithiová sůl v organickém rozpouštědle | 3 / 3,6 | ? | 2100 | dlouhá životnost |
| sekundární články | ||||||
| olověný akumulátor | +oxid olovičitý PbO2 −olovo Pb | kyselina sírová H2SO4 | 2 | 140 | 240 | tvrdý zdroj |
| nikl-ocelový akumulátor (NiFe) | +nikl Ni −ocel | hydroxid draselný KOH | 1,2 | ? | ? | nízká účinnost |
| nikl-kadmiový alkalický akumulátor | +nikl Ni −kadmium Cd | hydroxid draselný KOH | 1,2 | 120 | 350 | obyčejné dobíjecí baterie, jedovatý |
| nikl-metalhidridový akumulátor | +nikl Ni −vodík MH[pozn 1] | hydroxid draselný KOH | 1,2 | 280 | 720 | kvalitní akumulátory, nejedovatý |
| Lithium-iontový akumulátor | +uhlík C −oxid lithný Li2O | Chlorid Lithný LiCl + rozpouštědlo | 3,6 | ? | ? | Velmi vysoká kapacita |
| Lithium-polymerový | + ??? − ??? | 3,7 | ? | ? | Velmi vysoká kapacita | |
| Nikl-zinkový | + ??? − ??? | 1,6 | ? | ? | kvalitní akumulátory, nejedovatý | |
- Poznámka
Spojování galvanických článků
- Podrobnější informace naleznete na stránce: Elektrická baterie
Pro dosažení vyššího napětí se články spojují sériově do baterií, celkové elektrické napětí je pak dáno součtem dílčích napětí jednotlivých článků v baterii. Například plochá baterie obsahuje 3 suché články, 9V baterie obsahuje 6 suchých nebo alkalických článků, automobilový akumulátor obsahuje 6 akumulátorových článků. Pokud sériově zapojené články nemají stejnou kapacitu, může při hlubokém vybíjení být článek s nejnižší kapacitou vybit pod přípustnou mez, v extrémním případě dojde k reverzaci napětí na článku a jeho zničení. Při paralelním spojení článků zůstává elektrické napětí stejné, baterie jako celek však snese vyšší zatížení: Paralelním zapojením zdrojů se snižuje vnitřní odpor celkového zdroje a ten pak může dodávat větší elektrický proud. Paralelně spojovat je možno jen stejné články (typ i stupeň vybití), jinak vyrovnávací proudy mezi jednotlivými větvemi mohou způsobit i explozi vybitého článku.
Použití galvanických článků
Galvanické články se nacházejí především v přenosných elektrických spotřebičích - baterkách, hodinkách, mobilních telefonech, přenosných počítačích, fotoaparátech a kamerách, tzn. všude tam, kde se nelze připojit k elektrické síti nebo přímo použít mechanický zdroj (generátor). Výhodou galvanických článků bývá snadná přenosnost, malé rozměry, relativně nízká hmotnost. Nevýhodou může být nízké elektromotorické napětí, nízký výkon a krátká životnost. Akumulátory je možné rovněž použít k uložení elektrické energie, potřebné při přerušení dodávky ze sítě, např. v záložních zdrojích nebo jako zdroj elektřiny ve stojícím automobilu.
Historie galvanických článků
Galvanické články dostaly svůj název podle italského lékaře a přírodovědce Luigiho Galvaniho, který při pitvání žabích stehýnek zpozoroval jejich záškuby po dotyku kovového předmětu, podobné záškubům vyvolaných elektrickým nábojem. Tento jev správně vysvětlil italský fyzik Alessandro Volta, a to vznikem elektrického napětí mezi dvěma kovy (nástrojem a kovovým podkladem) vodivě propojenými elektrolytem (obsaženým v buňkách). Na základě těchto úvah sestavil v roce 1800 článek, skládající se z měděné a zinkové elektrody ponořené do roztoku kyseliny sírové. Voltův článek dával napětí přibližně 1 V a stal se prvním zdrojem stálého elektrického proudu, do té doby se elektřina vytvářela třením nebo indukční elektrikou. Objev Voltova článku umožnil obrovský rozvoj zkoumání elektrických jevů.
Související články
Externí odkazy
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |