Multimediaexpo.cz je již 18 let na českém internetu !!
Oxid dusný
Z Multimediaexpo.cz

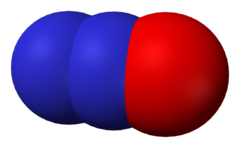
Oxid dusný, triviálním názvem rajský plyn či azoxid, v medicíně nazývaný Nitrogenium oxydulatum nebo Dinitrogenii oxidum, je za laboratorních podmínek bezbarvý a nehořlavý plyn.
Oxid dusný má sice nevýraznou, ale příjemnou vůní a nasládlou chutí.
Obsah |
Příprava
Oxid dusný se připravuje tepelným rozkladem dusičnanu amonného:
- NH4NO3 → N2O + 2 H2O.
Tato reakce je silně exotermní, při lokálním přehřátí může probíhat až explozivně; to je i podstatou průmyslových trhavin na bázi dusičnanu amonného. Mnohem bezpečnější je příprava zahříváním směsi alkalického dusičnanu (např. dusičnanu sodného) se síranem amonným
- 2 NaNO3 + (NH4)2SO4 → Na2SO4 + 2 N2O + 4 H2O,
nebo redukcí kyseliny dusičné například chloridem cínatým za přítomnosti kyseliny solné
- 2 HNO3 + 4 SnCl2 + 8 HCl → 4 SnCl4 + N2O + 5 H2O,
nebo zinkem za přítomnosti kyseliny sírové
- 2 HNO3 + 4 Zn + 4 H2SO4 → 4 ZnSO4 + N2O + 5 H2O.
Chemické vlastnosti
Molekula oxidu dusného je lineární (grupa symetrie C∞v). Na základě výpočtů byl určen řád vazby N–N 2,73 a N–O 1,61, což znamená, že vazba mezi dusíkovými atomy leží mezi dvojnou a trojnou vazbou, zatímco mezi kyslíkovým a dusíkovým atomem mezi jednoduchou a dvojnou vazbou. Proto strukturní vzorec N2O musí být zobrazován dvěma krajními mezomerními stavy. Jeho elektronová struktura je velmi blízká (téměř izoelektronová) struktuře molekuly oxidu uhličitého CO2. Jeho reaktivita je za normální teploty nízká. Po zahřátí na 600 °C se však rozkládá na dusík a kyslík. Protože v prvním stupni tohoto rozkladu vzniká molekulární dusík a atomární kyslík
- 2 N2O → 2 N2 + 2 O → 2 N2 + O2,
působí za těchto vyšších teplot jako velmi silné oxidační činidlo. To vede k některým jeho aplikacím. Působením elektrického výboje se dá směs plynného oxidu dusného s vodíkem přivést k explozivní reakci
- N2O + H2 → N2 + H2O.
Vzhledem k tomu, že se při této reakci prakticky nemění objem, nemá tato exploze velkou brizanci.
Ekologické vlivy


Vliv na ozonovou vrstvu Země
V srpnu 2009 byla v časopise Science publikována studie, podle které oxid dusný v současnosti představuje největší nebezpečí (větší než tzv. freony) pro ozonovou vrstvu Země měl by jím být i v průběhu celého 21. století, Zhruba dvě třetiny celkových ročních emisí (cca 20 milionů tun) se uvolňují z půdy přirozenou cestou a zbývající třetina je výsledkem lidské činnosti, např. výroby a užívání průmyslových hnojiv.[1]
Vliv na klima
Oxid dusný patří mezi skleníkové plyny, jejichž emise jsou regulovány Kjótským protokolem. Jedna tuna oxidu dusného způsobuje stejný skleníkový efekt jako 200 tun oxidu uhličitého nebo 10 tun methanu.
Účinky na lidské zdraví
Vdechován působí nejprve stavy veselosti (odtud název rajský plyn) nebo hysterie, při vyšších dávkách útlum až anestetický spánek. Dlouhodobé nebo intenzivní vdechování však může vést k zástavě dýchání, nebo přílišnému útlumu srdeční činnosti, případně až k zástavě srdce, v obou případech s následkem smrti. Proto je velmi nebezpečné jeho případné zneužití čicháním jako drogy.
Využití
- V medicíně se dříve používal ve směsi s kyslíkem (85 % N2O + 15 % O2) jako anestetikum ke krátkodobým narkózám; dnes aplikován dávkovacím zařízením (např. Entonox) zajišťujícím bezpečnost se může používat v porodnictví nebo ve stomatologii.
- Používá se jako hnací plyn v bombičkách na přípravu šlehačky (E 942).
- V raketových motorech, zejména hybridních, slouží jako oxidační činidlo.
- V některých případech (dragstery) se vstřikuje do spalovacích motorů pro zvýšení výkonu, protože jeho rozkladem se získá více kyslíku než ze vzduchu. Také ho z tohoto důvodu používají nelegální závodníci.
- Ze stejných důvodů se využívá v analytické chemii v metodě atomové absorpční spektrometrie (AAS) jako oxidační plyn při spalování ethynu namísto vzduchu. Je tak možno dosáhnout teploty plamene o teplotě téměř 3000 °C a analyzovat tak prvky s velmi stabilními oxidy, např. hliník nebo titan.
Historická poznámka
Oxid dusný pozoroval poprvé John Mayow v roce 1669 a později Joseph Priestley v roce 1772. O dvacet let později Humphry Davy stanovil jeho složení a testoval jej na sobě a přátelích. Výsledkem těchto testů bylo objevení narkotických vlastností oxidu dusného, což vedlo k jeho používání v humánní medicíně.
Při porodech byl poprvé použit jako anestetikum S. Klikovičem v roce 1880 v Petrohradu. Většího rozšíření v porodnictví doznal však až po roce 1915.
Za druhé světové války oxid dusný používala německá stíhací letadla s pístovými motory ke krátkodobému zvýšení jejich výkonu.
Reference
Externí odkazy
- (anglicky) Nitro Oxid System u spalovacích motorů
- (anglicky) Nitrous oxide fingered as monster ozone slayer, Science News
- Oxid dusný - Integrovaný registr znečišťování
| Oxidy s prvkem v oxidačním čísle I. |
|---|
|
Oxid měďný (Cu2O) • Oxid chlorný (Cl2O) • Oxid lithný (Li2O) • Oxid cesný (Cs2O) • Oxid dusný (N2O) • Oxid draselný (K2O) • Oxid rubidný (Rb2O) • |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |