Multimediaexpo.cz je již 18 let na českém internetu !!
Oxid fosforečný
Z Multimediaexpo.cz
Oxid fosforečný (P4O10) je anorganický oxid. Je to nejběžnější a nejdůležitější oxid fosforu. Vzniká hořením fosforu na vzduchu a vzhledem připomíná bílý prášek. Je dobře rozpustný v mnoha organických rozpouštědlech a je silně hygroskopický.
Obsah |
Struktura
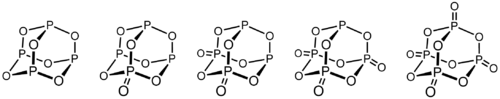
Molekula má adamantanoidní tvar, je tvořena čtyřmi šestičlennými cykly P3O3 s židličkovou konformací. Symetrie molekuly je tetraedrická. Oxid fosforečný tvoří nejméně čtyři polymorfní krystalové modifikace.
Příprava
Oxid fosforečný se připravuje řízenou oxidací bílého fosforu na vzduchu, při tlaku 12 kPa. Vznikající produkt je kontinuálně oddestilováván z reakční směsi.
- P4 + 5 O2 → P4O10
Použití
Někdy se používá jako dehydratační činidlo, ale jeho využitelnost je snížena tvorbou viskózního fosforečnanového gelu na povrchu oxidu, který brání další hydrolýze.
- P4O10 (am) + 6H2O (lq) → 4H3PO4 (c) (+177 kJ)
Při reakci s karboxylovou kyselinou vzniká odpovídající anhydrid:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
Příbuzné oxidy fosforu
Mezi P4O6 a P4O10 existují tři oxidy, které se liší počtem exocyklicky vázaných kyslíků.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
| Oxidy s prvkem v oxidačním čísle V. |
|---|
|
Oxid antimoničný (Sb2O5) • Oxid arseničný (As2O5) • Oxid dusičný (N2O5) • Oxid fosforečný (P4O10) • Oxid niobičný (Nb2O5) • |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
