Multimediaexpo.cz je již 18 let na českém internetu !!
V tiskové zprávě k 18. narozeninám brzy najdete nové a zásadní informace.
Izochorický děj
Z Multimediaexpo.cz
(++) |
m (Nahrazení textu „<math>“ textem „<big>\(“) |
||
| Řádka 1: | Řádka 1: | ||
| - | '''Izochorický děj''' je [[termodynamický děj]], při kterém zůstává konstantní [[objem]] [[termodynamická soustava|termodynamické soustavy]]. Při izochorickém ději je tedy < | + | '''Izochorický děj''' je [[termodynamický děj]], při kterém zůstává konstantní [[objem]] [[termodynamická soustava|termodynamické soustavy]]. Při izochorickém ději je tedy <big>\(V = \mbox{konst}</math>, tedy <big>\(\mathrm{d}V = 0</math>. |
[[Soubor:Isochoric process SVG.png|thumb|240px|Izochorický děj (2013)]] | [[Soubor:Isochoric process SVG.png|thumb|240px|Izochorický děj (2013)]] | ||
==Ideální plyn== | ==Ideální plyn== | ||
V případě [[Ideální plyn|ideálního plynu]] lze pro izochorický děj ze [[Stavová rovnice|stavové rovnice]] odvodit '''[[Charlesův zákon]]''' | V případě [[Ideální plyn|ideálního plynu]] lze pro izochorický děj ze [[Stavová rovnice|stavové rovnice]] odvodit '''[[Charlesův zákon]]''' | ||
| - | :< | + | :<big>\(\frac{p}{T} = \mbox{konst}</math>, |
| - | kde < | + | kde <big>\(p</math> je [[tlak]] a <big>\(T</math> je [[termodynamická teplota]] plynu. Při izochorickém ději je tedy podíl tlaku a teploty ideálního plynu stálý. |
==Izochora== | ==Izochora== | ||
| Řádka 11: | Řádka 11: | ||
==Vlastnosti== | ==Vlastnosti== | ||
| - | Poněvadž se při izochorickém ději nemění [[objem]] < | + | Poněvadž se při izochorickém ději nemění [[objem]] <big>\(V</math>, bude podle [[první termodynamický zákon|první věty termodynamické]] platit vztah |
| - | :< | + | :<big>\(\delta Q=\mathrm{d}U</math>, |
| - | kde < | + | kde <big>\(Q</math> je [[teplo]] a <big>\(U</math> je [[vnitřní energie]]. |
| - | Protože < | + | Protože <big>\(\delta A=p\mathrm{d}V</math> je [[Práce (fyzika)|práce]] vykonaná plynem (nebo dodaná plynu), lze tvrdit, že <big>\(\delta A=0</math>. To znamená, že při izochorickém ději plyn nevykonává (ani nepřijímá) žádnou práci. |
| - | Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie < | + | Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie <big>\(U</math>. |
| - | Teplo dodané plynu zvýší jeho [[teplota|teplotu]] o < | + | Teplo dodané plynu zvýší jeho [[teplota|teplotu]] o <big>\(\Delta T</math>. K vyjádření tohoto tepla lze použít molární [[tepelná kapacita|tepelnou kapacitu]] při stálém objemu <big>\(C_V</math>, tedy |
| - | :< | + | :<big>\(\delta Q = nC_V\mathrm{d}T = \mathrm{d}U</math>, |
| - | kde < | + | kde <big>\(n</math> je [[látkové množství]]. |
Integrací tohoto vztahu dostaneme | Integrací tohoto vztahu dostaneme | ||
| - | :< | + | :<big>\(Q = nC_V(T_2-T_1) = \Delta U</math> |
Vztah pro [[entropie|entropii]] při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru | Vztah pro [[entropie|entropii]] při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru | ||
| - | :< | + | :<big>\(\Delta S = nC_V\ln{\frac{T_2}{T_1}} = nC_V\ln{\frac{p_2}{p_1}}</math> |
| - | Dodáme-li soustavě při [[izobarický děj|izobarickém ději]] stejné množství [[teplo|tepla]] jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí < | + | Dodáme-li soustavě při [[izobarický děj|izobarickém ději]] stejné množství [[teplo|tepla]] jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí <big>\(C_p>C_V</math>. |
| - | Vztah mezi < | + | Vztah mezi <big>\(C_p</math> a <big>\(C_V</math> určuje [[Poissonova konstanta]] a [[Mayerův vztah]]. |
==Související články== | ==Související články== | ||
Verze z 14. 8. 2022, 14:48
Izochorický děj je termodynamický děj, při kterém zůstává konstantní objem termodynamické soustavy. Při izochorickém ději je tedy \(V = \mbox{konst}</math>, tedy \(\mathrm{d}V = 0</math>.
Obsah |
Ideální plyn
V případě ideálního plynu lze pro izochorický děj ze stavové rovnice odvodit Charlesův zákon
- \(\frac{p}{T} = \mbox{konst}</math>,
kde \(p</math> je tlak a \(T</math> je termodynamická teplota plynu. Při izochorickém ději je tedy podíl tlaku a teploty ideálního plynu stálý.
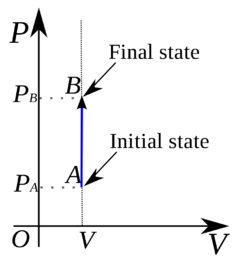
Izochora
Závislost tlaku na objemu při izochorickém ději je v p-V diagramu vyjádřena přímkou rovnoběžnou s osou p, která se nazývá izochora.
Vlastnosti
Poněvadž se při izochorickém ději nemění objem \(V</math>, bude podle první věty termodynamické platit vztah
- \(\delta Q=\mathrm{d}U</math>,
kde \(Q</math> je teplo a \(U</math> je vnitřní energie.
Protože \(\delta A=p\mathrm{d}V</math> je práce vykonaná plynem (nebo dodaná plynu), lze tvrdit, že \(\delta A=0</math>. To znamená, že při izochorickém ději plyn nevykonává (ani nepřijímá) žádnou práci.
Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie \(U</math>.
Teplo dodané plynu zvýší jeho teplotu o \(\Delta T</math>. K vyjádření tohoto tepla lze použít molární tepelnou kapacitu při stálém objemu \(C_V</math>, tedy
- \(\delta Q = nC_V\mathrm{d}T = \mathrm{d}U</math>,
kde \(n</math> je látkové množství. Integrací tohoto vztahu dostaneme
- \(Q = nC_V(T_2-T_1) = \Delta U</math>
Vztah pro entropii při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru
- \(\Delta S = nC_V\ln{\frac{T_2}{T_1}} = nC_V\ln{\frac{p_2}{p_1}}</math>
Dodáme-li soustavě při izobarickém ději stejné množství tepla jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí \(C_p>C_V</math>.
Vztah mezi \(C_p</math> a \(C_V</math> určuje Poissonova konstanta a Mayerův vztah.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |