Multimediaexpo.cz je již 18 let na českém internetu !!
V tiskové zprávě k 18. narozeninám brzy najdete nové a zásadní informace.
Izochorický děj
Z Multimediaexpo.cz
m (Nahrazení textu „<math>“ textem „<big>\(“) |
m (Nahrazení textu „</math>“ textem „\)</big>“) |
||
| Řádka 1: | Řádka 1: | ||
| - | '''Izochorický děj''' je [[termodynamický děj]], při kterém zůstává konstantní [[objem]] [[termodynamická soustava|termodynamické soustavy]]. Při izochorickém ději je tedy <big>\(V = \mbox{konst}</ | + | '''Izochorický děj''' je [[termodynamický děj]], při kterém zůstává konstantní [[objem]] [[termodynamická soustava|termodynamické soustavy]]. Při izochorickém ději je tedy <big>\(V = \mbox{konst}\)</big>, tedy <big>\(\mathrm{d}V = 0\)</big>. |
[[Soubor:Isochoric process SVG.png|thumb|240px|Izochorický děj (2013)]] | [[Soubor:Isochoric process SVG.png|thumb|240px|Izochorický děj (2013)]] | ||
==Ideální plyn== | ==Ideální plyn== | ||
V případě [[Ideální plyn|ideálního plynu]] lze pro izochorický děj ze [[Stavová rovnice|stavové rovnice]] odvodit '''[[Charlesův zákon]]''' | V případě [[Ideální plyn|ideálního plynu]] lze pro izochorický děj ze [[Stavová rovnice|stavové rovnice]] odvodit '''[[Charlesův zákon]]''' | ||
| - | :<big>\(\frac{p}{T} = \mbox{konst}</ | + | :<big>\(\frac{p}{T} = \mbox{konst}\)</big>, |
| - | kde <big>\(p</ | + | kde <big>\(p\)</big> je [[tlak]] a <big>\(T\)</big> je [[termodynamická teplota]] plynu. Při izochorickém ději je tedy podíl tlaku a teploty ideálního plynu stálý. |
==Izochora== | ==Izochora== | ||
| Řádka 11: | Řádka 11: | ||
==Vlastnosti== | ==Vlastnosti== | ||
| - | Poněvadž se při izochorickém ději nemění [[objem]] <big>\(V</ | + | Poněvadž se při izochorickém ději nemění [[objem]] <big>\(V\)</big>, bude podle [[první termodynamický zákon|první věty termodynamické]] platit vztah |
| - | :<big>\(\delta Q=\mathrm{d}U</ | + | :<big>\(\delta Q=\mathrm{d}U\)</big>, |
| - | kde <big>\(Q</ | + | kde <big>\(Q\)</big> je [[teplo]] a <big>\(U\)</big> je [[vnitřní energie]]. |
| - | Protože <big>\(\delta A=p\mathrm{d}V</ | + | Protože <big>\(\delta A=p\mathrm{d}V\)</big> je [[Práce (fyzika)|práce]] vykonaná plynem (nebo dodaná plynu), lze tvrdit, že <big>\(\delta A=0\)</big>. To znamená, že při izochorickém ději plyn nevykonává (ani nepřijímá) žádnou práci. |
| - | Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie <big>\(U</ | + | Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie <big>\(U\)</big>. |
| - | Teplo dodané plynu zvýší jeho [[teplota|teplotu]] o <big>\(\Delta T</ | + | Teplo dodané plynu zvýší jeho [[teplota|teplotu]] o <big>\(\Delta T\)</big>. K vyjádření tohoto tepla lze použít molární [[tepelná kapacita|tepelnou kapacitu]] při stálém objemu <big>\(C_V\)</big>, tedy |
| - | :<big>\(\delta Q = nC_V\mathrm{d}T = \mathrm{d}U</ | + | :<big>\(\delta Q = nC_V\mathrm{d}T = \mathrm{d}U\)</big>, |
| - | kde <big>\(n</ | + | kde <big>\(n\)</big> je [[látkové množství]]. |
Integrací tohoto vztahu dostaneme | Integrací tohoto vztahu dostaneme | ||
| - | :<big>\(Q = nC_V(T_2-T_1) = \Delta U</ | + | :<big>\(Q = nC_V(T_2-T_1) = \Delta U\)</big> |
Vztah pro [[entropie|entropii]] při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru | Vztah pro [[entropie|entropii]] při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru | ||
| - | :<big>\(\Delta S = nC_V\ln{\frac{T_2}{T_1}} = nC_V\ln{\frac{p_2}{p_1}}</ | + | :<big>\(\Delta S = nC_V\ln{\frac{T_2}{T_1}} = nC_V\ln{\frac{p_2}{p_1}}\)</big> |
| - | Dodáme-li soustavě při [[izobarický děj|izobarickém ději]] stejné množství [[teplo|tepla]] jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí <big>\(C_p>C_V</ | + | Dodáme-li soustavě při [[izobarický děj|izobarickém ději]] stejné množství [[teplo|tepla]] jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí <big>\(C_p>C_V\)</big>. |
| - | Vztah mezi <big>\(C_p</ | + | Vztah mezi <big>\(C_p\)</big> a <big>\(C_V\)</big> určuje [[Poissonova konstanta]] a [[Mayerův vztah]]. |
==Související články== | ==Související články== | ||
Aktuální verze z 14. 8. 2022, 14:52
Izochorický děj je termodynamický děj, při kterém zůstává konstantní objem termodynamické soustavy. Při izochorickém ději je tedy \(V = \mbox{konst}\), tedy \(\mathrm{d}V = 0\).
Obsah |
Ideální plyn
V případě ideálního plynu lze pro izochorický děj ze stavové rovnice odvodit Charlesův zákon
- \(\frac{p}{T} = \mbox{konst}\),
kde \(p\) je tlak a \(T\) je termodynamická teplota plynu. Při izochorickém ději je tedy podíl tlaku a teploty ideálního plynu stálý.
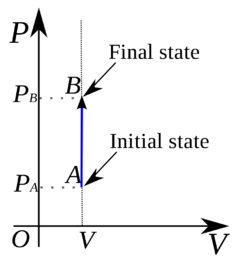
Izochora
Závislost tlaku na objemu při izochorickém ději je v p-V diagramu vyjádřena přímkou rovnoběžnou s osou p, která se nazývá izochora.
Vlastnosti
Poněvadž se při izochorickém ději nemění objem \(V\), bude podle první věty termodynamické platit vztah
- \(\delta Q=\mathrm{d}U\),
kde \(Q\) je teplo a \(U\) je vnitřní energie.
Protože \(\delta A=p\mathrm{d}V\) je práce vykonaná plynem (nebo dodaná plynu), lze tvrdit, že \(\delta A=0\). To znamená, že při izochorickém ději plyn nevykonává (ani nepřijímá) žádnou práci.
Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie \(U\).
Teplo dodané plynu zvýší jeho teplotu o \(\Delta T\). K vyjádření tohoto tepla lze použít molární tepelnou kapacitu při stálém objemu \(C_V\), tedy
- \(\delta Q = nC_V\mathrm{d}T = \mathrm{d}U\),
kde \(n\) je látkové množství. Integrací tohoto vztahu dostaneme
- \(Q = nC_V(T_2-T_1) = \Delta U\)
Vztah pro entropii při izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru
- \(\Delta S = nC_V\ln{\frac{T_2}{T_1}} = nC_V\ln{\frac{p_2}{p_1}}\)
Dodáme-li soustavě při izobarickém ději stejné množství tepla jako při ději izochorickém, bude přírustek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí \(C_p>C_V\).
Vztah mezi \(C_p\) a \(C_V\) určuje Poissonova konstanta a Mayerův vztah.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |